2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
19. (12 分)已知化学反应①:${Fe(s) + CO_{2}(g){<=>}FeO(s) + CO(g)}$,其平衡常数为 $K_{1}$;化学反应②:${Fe(s) + H_{2}O(g){<=>}FeO(s) + H_{2}(g)}$,其平衡常数为 $K_{2}$。在不同温度 $T$ 下 $(T_{1}<T_{2})$,$K_{1}$、$K_{2}$ 的值如下表所示:

请回答下列问题。
(1)通过表中数据可以推断:反应①是
(2)相同温度下,有反应③${CO_{2}(g) + H_{2}(g){<=>}CO(g) + H_{2}O(g)}$,则该反应的平衡常数表达式为 $K_{3}=$
(3)相同温度下,根据反应①②可推出 $K_{1}$、$K_{2}$ 与 $K_{3}$ 之间的关系式为
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有
A. 缩小反应容器的容积
B. 扩大反应容器的容积
C. 升高温度
D. 使用合适的催化剂
E. 设法减小平衡体系中 ${CO}$ 的浓度

请回答下列问题。
(1)通过表中数据可以推断:反应①是
吸热
(填“吸热”或“放热”)反应。(2)相同温度下,有反应③${CO_{2}(g) + H_{2}(g){<=>}CO(g) + H_{2}O(g)}$,则该反应的平衡常数表达式为 $K_{3}=$
c(CO)·c(H₂O)/c(CO₂)·c(H₂)
。(3)相同温度下,根据反应①②可推出 $K_{1}$、$K_{2}$ 与 $K_{3}$ 之间的关系式为
K₃=K₁/K₂
;据此关系式及表中数据,能推断出反应③是吸热
(填“吸热”或“放热”)反应。(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有
CE
(填字母)。A. 缩小反应容器的容积
B. 扩大反应容器的容积
C. 升高温度
D. 使用合适的催化剂
E. 设法减小平衡体系中 ${CO}$ 的浓度
答案:
19.答案
(1)吸热
(2)c(CO)·c(H₂O)/c(CO₂)·c(H₂)
(3)K₃=K₁/K₂ 吸热
(4)CE
(1)吸热
(2)c(CO)·c(H₂O)/c(CO₂)·c(H₂)
(3)K₃=K₁/K₂ 吸热
(4)CE
20. (12 分)(2024 湖北卷改编)用 ${BaCO_{3}}$ 和焦炭为原料,经反应Ⅰ、Ⅱ得到 ${BaC_{2}}$,再制备乙炔是我国科研人员提出的绿色环保新路线。
反应Ⅰ:${BaCO_{3}(s) + C(s){<=>}BaO(s) + 2CO(g)}$
反应Ⅱ:${BaO(s) + 3C(s){<=>}BaC_{2}(s) + CO(g)}$
回答下列问题。
(1)已知 $K_{p}=(p_{{CO}})^{n}$、$K=(\dfrac{p_{{CO}}}{10^{5}\ Pa})^{n}$ ($n$ 是 ${CO}$ 的化学计量数)。反应Ⅰ、Ⅱ的 $\lg K$ 与温度的关系曲线见图 $1$。
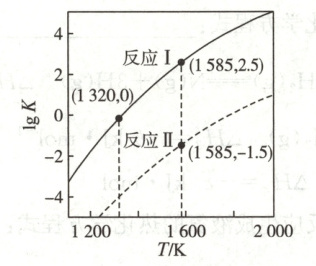
①反应 ${BaCO_{3}(s) + 4C(s){<=>}BaC_{2}(s) + 3CO(g)}$ 在 $1585\ K$ 的 $K_{p}=$
②保持 $1320\ K$ 不变,假定恒容容器中只发生反应Ⅰ,达到平衡时 $p_{{CO}}=$______ $Pa$;若将容器容积压缩到原来的 $\dfrac{1}{2}$,重新建立平衡后 $p_{{CO}}=$______ $Pa$。
(2)恒压容器中,焦炭与 ${BaCO_{3}}$ 的物质的量之比为 $4:1$,${Ar}$ 为载气。$1400\ K$ 和 $1823\ K$ 下,${BaC_{2}}$ 产率随时间的关系曲线依实验数据拟合得到图 $2$ (不考虑接触面积的影响)。
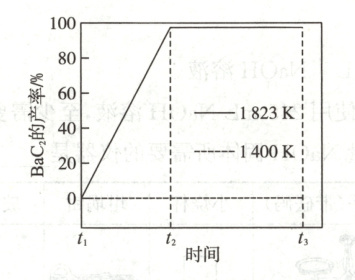
①初始温度为 $900\ K$,缓慢加热至 $1400\ K$ 时,实验表明 ${BaCO_{3}}$ 已全部消耗,此时反应体系中含 ${Ba}$ 物种为
②$1823\ K$ 下,反应速率的变化特点为______,其原因是______。
反应Ⅰ:${BaCO_{3}(s) + C(s){<=>}BaO(s) + 2CO(g)}$
反应Ⅱ:${BaO(s) + 3C(s){<=>}BaC_{2}(s) + CO(g)}$
回答下列问题。
(1)已知 $K_{p}=(p_{{CO}})^{n}$、$K=(\dfrac{p_{{CO}}}{10^{5}\ Pa})^{n}$ ($n$ 是 ${CO}$ 的化学计量数)。反应Ⅰ、Ⅱ的 $\lg K$ 与温度的关系曲线见图 $1$。

①反应 ${BaCO_{3}(s) + 4C(s){<=>}BaC_{2}(s) + 3CO(g)}$ 在 $1585\ K$ 的 $K_{p}=$
10¹⁶
$Pa^{3}$。②保持 $1320\ K$ 不变,假定恒容容器中只发生反应Ⅰ,达到平衡时 $p_{{CO}}=$______ $Pa$;若将容器容积压缩到原来的 $\dfrac{1}{2}$,重新建立平衡后 $p_{{CO}}=$______ $Pa$。
(2)恒压容器中,焦炭与 ${BaCO_{3}}$ 的物质的量之比为 $4:1$,${Ar}$ 为载气。$1400\ K$ 和 $1823\ K$ 下,${BaC_{2}}$ 产率随时间的关系曲线依实验数据拟合得到图 $2$ (不考虑接触面积的影响)。

①初始温度为 $900\ K$,缓慢加热至 $1400\ K$ 时,实验表明 ${BaCO_{3}}$ 已全部消耗,此时反应体系中含 ${Ba}$ 物种为
BaO
。②$1823\ K$ 下,反应速率的变化特点为______,其原因是______。
答案:
20.答案
(1)①10¹⁶ ②10⁵
(2)①BaO ②反应达到平衡前速率保持不变 容器中只有反应Ⅱ:BaO(s)+3C(s)⇌BaC₂(s)+CO(g),反应条件恒温(1823K)、恒压,且该反应只有CO为气态,根据K=pₐCO/10⁵Pa可知,CO的压强为定值,所以化学反应速率不变
解析
(2)①由题图可知,1400K时,BaC₂的产率为0,即没有BaC₂生成,又实验表明BaCO₃已全部消耗,所以此时反应体系中含Ba物种为BaO。
②图像显示,1823K时BaC₂的产率随时间由0开始呈直线增加到接近100%,说明该反应速率为定值,即速率保持不变;1400K时碳酸钡已全部消耗,此时反应体系的含钡物种只有氧化钡,即1823K时只发生反应Ⅱ:BaO(s)+3C(s)⇌BaC₂(s)+CO(g),反应条件为恒温(1823K)、恒压,且该反应只有CO为气态,根据K=pₐCO/10⁵Pa可知,CO的压强为定值,所以化学反应速率不变。
(1)①10¹⁶ ②10⁵
(2)①BaO ②反应达到平衡前速率保持不变 容器中只有反应Ⅱ:BaO(s)+3C(s)⇌BaC₂(s)+CO(g),反应条件恒温(1823K)、恒压,且该反应只有CO为气态,根据K=pₐCO/10⁵Pa可知,CO的压强为定值,所以化学反应速率不变
解析
(2)①由题图可知,1400K时,BaC₂的产率为0,即没有BaC₂生成,又实验表明BaCO₃已全部消耗,所以此时反应体系中含Ba物种为BaO。
②图像显示,1823K时BaC₂的产率随时间由0开始呈直线增加到接近100%,说明该反应速率为定值,即速率保持不变;1400K时碳酸钡已全部消耗,此时反应体系的含钡物种只有氧化钡,即1823K时只发生反应Ⅱ:BaO(s)+3C(s)⇌BaC₂(s)+CO(g),反应条件为恒温(1823K)、恒压,且该反应只有CO为气态,根据K=pₐCO/10⁵Pa可知,CO的压强为定值,所以化学反应速率不变。
查看更多完整答案,请扫码查看


