2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. 已知:①2C(s)+O₂(g)=2CO(g) ΔH = -220 kJ·mol⁻¹
②氢气燃烧的能量变化示意图:
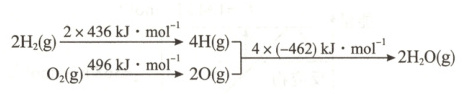
下列说法正确的是(
A.1 mol C(s)完全燃烧放出 110 kJ 的热量
B.H₂(g)+$\frac{1}{2}$O₂(g)=H₂O(g) ΔH = -240 kJ·mol⁻¹
C.C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = -130 kJ·mol⁻¹
D.欲分解 2 mol H₂O(l),至少需要提供 4×462 kJ 的热量
②氢气燃烧的能量变化示意图:
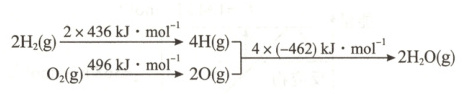
下列说法正确的是(
B
)。A.1 mol C(s)完全燃烧放出 110 kJ 的热量
B.H₂(g)+$\frac{1}{2}$O₂(g)=H₂O(g) ΔH = -240 kJ·mol⁻¹
C.C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = -130 kJ·mol⁻¹
D.欲分解 2 mol H₂O(l),至少需要提供 4×462 kJ 的热量
答案:
15.B 解析1molC(s)燃烧生成CO时放出110kJ热量,此时不是完全燃烧,A项错误;根据氢气燃烧的能量变化示意图,可得热化学方程式②2H₂(g)+O₂(g)⇌2H₂O(g)ΔH=2×436kJ·mol⁻¹+496kJ·mol⁻¹-4×462kJ·mol⁻¹=-480kJ·mol⁻¹,故$H₂(g)+\frac{1}{2}O₂(g)⇌H₂O(g)ΔH=-240kJ·mol⁻¹,$B项正确;根据盖斯定律,由$\frac{①-②}{2}$可得目标热化学方程式,即C(s)+H₂O(g)⇌CO(g)+H₂(g)ΔH=+130kJ·mol⁻¹,C项错误;由图中信息可知,分解2molH₂O(g)至少需要提供4×462kJ的热量,而分解2molH₂O(l)需要提供的热量更多,D项错误。
16. (8 分)用如图所示装置进行中和反应反应热的测定实验,请回答下列问题。
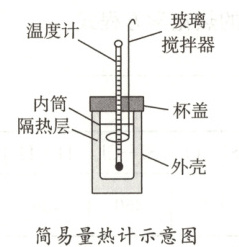
(1)取 30 mL 0.5 mol·L⁻¹ H₂SO₄ 溶液与 50 mL 0.5 mol·L⁻¹ NaOH 溶液进行中和反应,三次实验温度平均升高 4.1℃,已知中和后生成的溶液的比热容为 4.18 J·(g·℃)⁻¹,溶液的密度均为 1 g·mL⁻¹,通过计算可得生成 1 mol H₂O 时放出的热量为
(2)上述实验数值与 57.3 有偏差,产生此偏差的原因可能是
a. 实验装置保温、隔热效果差
b. 用温度计测量 NaOH 溶液起始温度后直接测量 H₂SO₄ 溶液的温度
c. 一次性把 NaOH 溶液倒入盛有硫酸的小烧杯中
(3)实验中若改用 60 mL 0.25 mol·L⁻¹ H₂SO₄ 溶液与 50 mL 0.55 mol·L⁻¹ NaOH 溶液进行反应,与上述实验相比,通过计算可得生成 1 mol H₂O 时所放出的热量

(1)取 30 mL 0.5 mol·L⁻¹ H₂SO₄ 溶液与 50 mL 0.5 mol·L⁻¹ NaOH 溶液进行中和反应,三次实验温度平均升高 4.1℃,已知中和后生成的溶液的比热容为 4.18 J·(g·℃)⁻¹,溶液的密度均为 1 g·mL⁻¹,通过计算可得生成 1 mol H₂O 时放出的热量为
54.8
kJ。(保留小数点后一位)(2)上述实验数值与 57.3 有偏差,产生此偏差的原因可能是
ab
(填字母)。a. 实验装置保温、隔热效果差
b. 用温度计测量 NaOH 溶液起始温度后直接测量 H₂SO₄ 溶液的温度
c. 一次性把 NaOH 溶液倒入盛有硫酸的小烧杯中
(3)实验中若改用 60 mL 0.25 mol·L⁻¹ H₂SO₄ 溶液与 50 mL 0.55 mol·L⁻¹ NaOH 溶液进行反应,与上述实验相比,通过计算可得生成 1 mol H₂O 时所放出的热量
相等
(填“相等”或“不相等”)。若用 30 mL 1 mol·L⁻¹ 醋酸代替 H₂SO₄ 溶液进行上述实验,测得的反应前后温度的变化值会偏小
(填“偏大”“偏小”或“不受影响”)。
答案:
16.答案
(1)54.8
(2)ab
(3)相等偏小
(1)54.8
(2)ab
(3)相等偏小
查看更多完整答案,请扫码查看


