2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (10 分)某实验小组用 $0.50\ mol·L^{-1}\ {NaOH}$ 溶液和 $0.50\ mol·L^{-1}$ 硫酸进行中和反应反应热的测定。
Ⅰ. 配制 $0.50\ mol·L^{-1}\ {NaOH}$ 溶液。
(1)若实验中大约要使用 $245\ mL\ {NaOH}$ 溶液,至少需要称量 ${NaOH}$ 固体
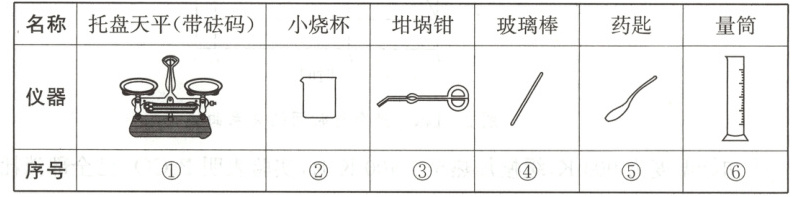
(2)从表中选择,称量 ${NaOH}$ 固体所需要的仪器是
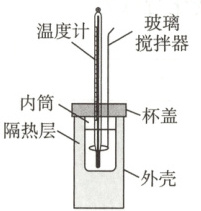
Ⅱ. 测定稀硫酸与稀氢氧化钠溶液中和反应反应热的实验装置如图所示。
(1)若生成 $1\ mol\ {H_{2}O}$ 时反应放出的热量为 $57.3\ kJ$,写出该反应的热化学方程式:______。
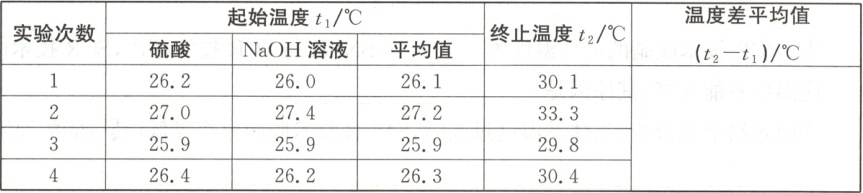
(2)取 $50\ mL\ {NaOH}$ 溶液和 $30\ mL$ 硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
②用上述实验数值计算结果为 $53.5\ kJ·mol^{-1}$,与 $57.3\ kJ·mol^{-1}$ 有偏差,产生偏差的原因可能是
A. 测完硫酸的温度直接测 ${NaOH}$ 溶液的温度
B. 做该实验时室温较高
C. 杯盖未盖严
D. ${NaOH}$ 溶液一次性迅速倒人
Ⅰ. 配制 $0.50\ mol·L^{-1}\ {NaOH}$ 溶液。
(1)若实验中大约要使用 $245\ mL\ {NaOH}$ 溶液,至少需要称量 ${NaOH}$ 固体
5.0
$g$。(2)从表中选择,称量 ${NaOH}$ 固体所需要的仪器是
①②⑤
(填序号)。
Ⅱ. 测定稀硫酸与稀氢氧化钠溶液中和反应反应热的实验装置如图所示。

(1)若生成 $1\ mol\ {H_{2}O}$ 时反应放出的热量为 $57.3\ kJ$,写出该反应的热化学方程式:______。
(2)取 $50\ mL\ {NaOH}$ 溶液和 $30\ mL$ 硫酸进行实验,实验数据如下表。
①请填写下表中的空白:

②用上述实验数值计算结果为 $53.5\ kJ·mol^{-1}$,与 $57.3\ kJ·mol^{-1}$ 有偏差,产生偏差的原因可能是
AC
(填字母)。A. 测完硫酸的温度直接测 ${NaOH}$ 溶液的温度
B. 做该实验时室温较高
C. 杯盖未盖严
D. ${NaOH}$ 溶液一次性迅速倒人
答案:
17.答案 I.
(1)5.0
(2)①②⑤
Ⅱ.
(1)1/2H₂SO₄(aq)+NaOH(aq)=1/2Na₂SO₄(aq)+H₂O(l) ΔH=−57.3kJ·mol⁻¹
(2)①4.0 ②AC
解析 Ⅱ.
(2)①每次实验温度差=终止温度t₂−起始温度t₁的平均值,第2组偏差太大,舍弃,则最终温度差平均值为第1、3、4三组实验的温度差之和除以3。
②测完硫酸的温度直接测NaOH溶液的温度,温度计上残留的酸液未用水冲洗干净,导致一部分反应物损失,使测得的数值偏小,A项可能;做该实验时室温较高,不会影响实验结果,B项不可能;杯盖未盖严会导致热量散失,使测得的数值偏小,C项可能;NaOH溶液一次性迅速倒入可以减少实验误差,减少热量损失,D项不可能。
(1)5.0
(2)①②⑤
Ⅱ.
(1)1/2H₂SO₄(aq)+NaOH(aq)=1/2Na₂SO₄(aq)+H₂O(l) ΔH=−57.3kJ·mol⁻¹
(2)①4.0 ②AC
解析 Ⅱ.
(2)①每次实验温度差=终止温度t₂−起始温度t₁的平均值,第2组偏差太大,舍弃,则最终温度差平均值为第1、3、4三组实验的温度差之和除以3。
②测完硫酸的温度直接测NaOH溶液的温度,温度计上残留的酸液未用水冲洗干净,导致一部分反应物损失,使测得的数值偏小,A项可能;做该实验时室温较高,不会影响实验结果,B项不可能;杯盖未盖严会导致热量散失,使测得的数值偏小,C项可能;NaOH溶液一次性迅速倒入可以减少实验误差,减少热量损失,D项不可能。
查看更多完整答案,请扫码查看


