第94页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
4. 氢气可作燃料,若$40$ g氢气完全燃烧,需要氧气的质量是多少?
答案:
4.[解]设:需要氧气的质量为x。
$2H₂+O₂\overset{点燃}{=}2H₂O$
4 32
40g x
$\frac{4}{32}=\frac{40g}{x} x=320g$
答:需要氧气的质量为320g。
$2H₂+O₂\overset{点燃}{=}2H₂O$
4 32
40g x
$\frac{4}{32}=\frac{40g}{x} x=320g$
答:需要氧气的质量为320g。
5. 纳米铝冰作为火箭固体推进剂具有广阔的应用前景。$480$℃以上时,发生的主要反应为${2Al + 3H_{2}O \xlongequal{\triangle} Al_{2}O_{3} + 3H_{2}↑}$。该反应中,若有$54$ kg Al发生反应,计算参加反应的${H_{2}O}$的质量。
答案:
5.[解]设:参加反应的H₂O的质量为x。
$2Al+3H₂O\overset{\triangle}{=}Al₂O₃+3H₂↑$
54 54
54kg x
$\frac{54}{54}=\frac{54kg}{x} x=54kg$
答:参加反应的H₂O的质量为54kg。
$2Al+3H₂O\overset{\triangle}{=}Al₂O₃+3H₂↑$
54 54
54kg x
$\frac{54}{54}=\frac{54kg}{x} x=54kg$
答:参加反应的H₂O的质量为54kg。
6. 实验室用$68$ g过氧化氢溶液和$2$ g二氧化锰制取氧气,实验的相关数据如图所示。

(1)反应生成氧气的质量为
(2)参加反应的过氧化氢的质量是多少?

(1)反应生成氧气的质量为
1.6
g。(2)参加反应的过氧化氢的质量是多少?
答案:
6.
(1)1.6
(2)[解]设:参加反应的过氧化氢的质量为x。
$2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑$
68 32
x 1.6g
$\frac{68}{32}=\frac{x}{1.6g} x=3.4g$
答:参加反应的过氧化氢的质量是3.4g。
(1)1.6
(2)[解]设:参加反应的过氧化氢的质量为x。
$2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑$
68 32
x 1.6g
$\frac{68}{32}=\frac{x}{1.6g} x=3.4g$
答:参加反应的过氧化氢的质量是3.4g。
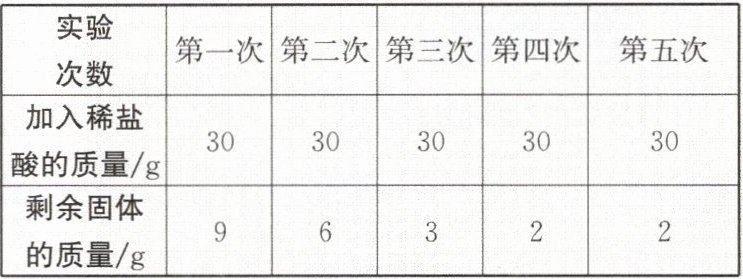
7. 某兴趣小组为测定石灰石中碳酸钙的质量分数,取$12$ g石灰石样品加入烧杯中,将$150$ g稀盐酸平均分成五次加入,充分反应后(杂质不溶于水也不与稀盐酸反应,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳),测得实验数据如下表所示。
计算:
(1)此石灰石中碳酸钙的质量分数是多少?(结果精确到$0.1\%$)
(2)生成气体的质量是多少?

计算:
(1)此石灰石中碳酸钙的质量分数是多少?(结果精确到$0.1\%$)
(2)生成气体的质量是多少?
答案:
7.
(1)[解]由表可知,最终剩余固体的质量为2g,故石灰石样品中碳酸钙的质量为12g−2g=10g,样品中碳酸钙的质量分数为$\frac{10g}{12g}×100\%≈83.3\%。$
答:此石灰石中碳酸钙的质量分数是83.3%。
(2)[解]设:生成气体的质量为x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
10g x
$\frac{100}{44}=\frac{10g}{x} x=4.4g$
答:生成气体的质量为4.4g。
(1)[解]由表可知,最终剩余固体的质量为2g,故石灰石样品中碳酸钙的质量为12g−2g=10g,样品中碳酸钙的质量分数为$\frac{10g}{12g}×100\%≈83.3\%。$
答:此石灰石中碳酸钙的质量分数是83.3%。
(2)[解]设:生成气体的质量为x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
10g x
$\frac{100}{44}=\frac{10g}{x} x=4.4g$
答:生成气体的质量为4.4g。
8. 某治疗胃酸过多的药片的主要成分为碳酸氢钠(含少量碳酸钠)。为了测定药片中碳酸氢钠的含量,将药片研碎,取$4.0$ g样品加热到质量不再减少,收集到的气体经干燥后质量为$0.88$ g。(碳酸氢钠受热分解的化学方程式:${2NaHCO_{3} \xlongequal{\triangle} Na_{2}CO_{3} + H_{2}O + CO_{2}↑}$,样品中其他成分受热不分解)
(1)碳酸钠中钠、碳、氧三种元素的质量比是
(2)计算该样品中碳酸氢钠的质量分数。
(1)碳酸钠中钠、碳、氧三种元素的质量比是
23:6:24
(最简整数比)。(2)计算该样品中碳酸氢钠的质量分数。
答案:
8.
(1)23:6:24
(2)[解]设:该样品中碳酸氢钠的质量为x。
$2NaHCO₃\overset{\triangle}{=}Na₂CO₃+H₂O+CO₂↑$
168 44
x 0.88g
$\frac{168}{44}=\frac{x}{0.88g} x=3.36g$
该样品中碳酸氢钠的质量分数为$\frac{3.36g}{4.0g}×100\%=84%。$
答:该样品中碳酸氢钠的质量分数为84%。
(1)23:6:24
(2)[解]设:该样品中碳酸氢钠的质量为x。
$2NaHCO₃\overset{\triangle}{=}Na₂CO₃+H₂O+CO₂↑$
168 44
x 0.88g
$\frac{168}{44}=\frac{x}{0.88g} x=3.36g$
该样品中碳酸氢钠的质量分数为$\frac{3.36g}{4.0g}×100\%=84%。$
答:该样品中碳酸氢钠的质量分数为84%。
查看更多完整答案,请扫码查看


