第87页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
【例 1】化学方程式$2Mg+O_{2}\overset{ 点燃}{=}2MgO$,所表示的意义正确的是(
A.镁加氧气等于氧化镁
B.$2$份质量的镁和$1$份质量的氧气生成$2$份质量的氧化镁
C.镁与空气反应生成氧化镁
D.镁与氧气在点燃的条件下反应生成氧化镁
D
)。A.镁加氧气等于氧化镁
B.$2$份质量的镁和$1$份质量的氧气生成$2$份质量的氧化镁
C.镁与空气反应生成氧化镁
D.镁与氧气在点燃的条件下反应生成氧化镁
答案:
【例1】D
四位同学正在讨论某一个化学方程式的意义,他们所描述的化学方程式是(
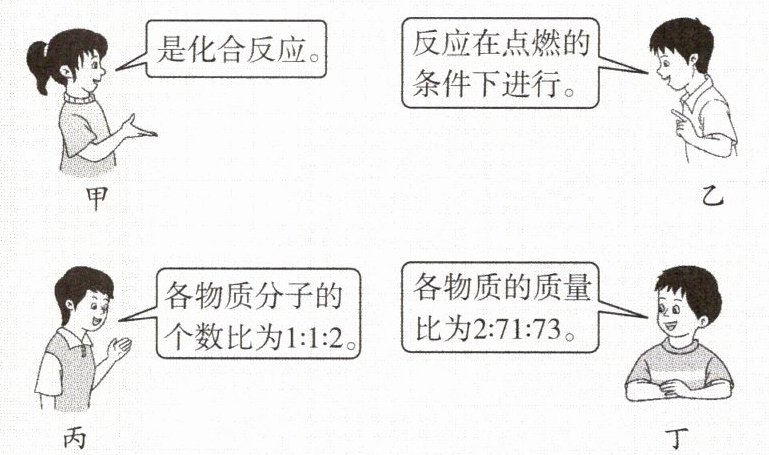
A.$C+O_{2}\overset{ 点燃}{=}CO_{2}$
B.$2CO+O_{2}\overset{ 点燃}{=}2CO_{2}$
C.$H_{2}+Cl_{2}\overset{ 点燃}{=}2HCl$
D.$2Mg+O_{2}\overset{ 点燃}{=}2MgO$
C
)。
A.$C+O_{2}\overset{ 点燃}{=}CO_{2}$
B.$2CO+O_{2}\overset{ 点燃}{=}2CO_{2}$
C.$H_{2}+Cl_{2}\overset{ 点燃}{=}2HCl$
D.$2Mg+O_{2}\overset{ 点燃}{=}2MgO$
答案:
【即学即练】C
问题情境
1. ①$Mg+O_{2}\overset{ 点燃}{=}MgO_{2}$;②$H_{2}+O_{2}\overset{ 点燃}{=}H_{2}O$
上述两个化学方程式的书写均不对,请写出书写化学方程式应该遵循的原则,并改正上述化学方程式。
2. 配平时,为什么不能改动化学式中元素符号右下角的数字?
3. 确定化学式前的化学计量数的方法有哪些?怎样判断化学方程式是否配平?
归纳总结
1. 配平化学方程式的方法。
(1) 最小公倍数法。
找出式子两边各出现一次,且原子个数不相等又相差较大的元素,求出其原子个数的最小公倍数,用最小公倍数分别除以含有该元素的化学式中该元素的原子个数,确定该物质的化学计量数,并加以配平。
(2) 奇偶配平法(以过氧化氢制氧气:$H_{2}O_{2}\overset{MnO_{2}}{ --}H_{2}O+O_{2}$为例)。
① 找出式子左右两端出现次数较多的元素(式子左、右两边出现次数最多的元素是氧元素)。
② 该元素的原子在两端的总数若是一奇一偶,则选定这一元素作为配平的起点,将其配成偶数(式子左边的氧原子个数为偶数,而右边$H_{2}O$的氧原子个数为奇数,因此将水分子数配成偶数)。
③ 由已推出的化学计量数得出其他化学式的化学计量数(再配平其他的元素)。
(3) 定一法。
① 设某物质的化学计量数为$1$。选择化学方程式中最复杂的化学式,设其化学计量数为$1$。
② 推导其他物质的化学计量数。根据质量守恒定律,即化学反应前后原子的种类和个数不变,通过比较反应前后各元素的原子个数,推导出其他物质的化学计量数。
③ 化为整数。最后将分数形式的化学计量数化为整数,确保化学方程式两边的原子个数相等。
2. 化学方程式书写注意事项。
(1) 书写注意事项。
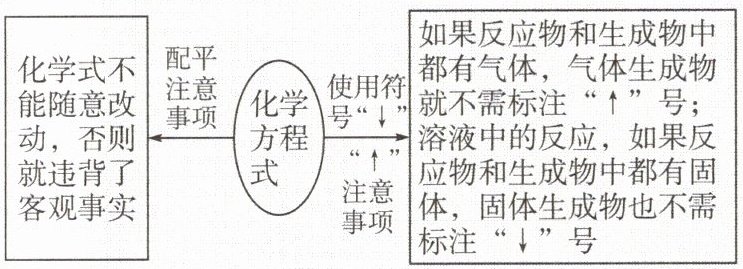
(2) 正确区分“加热”“点燃”与“高温”等反应条件。
① “加热”与“高温”。“加热”常用“△”号表示,一般指温度在常温以上,$800^{\circ}C$以下。若加热时温度高于$800^{\circ}C$,通常称为“高温”。
② “点燃”。一般认为有燃烧现象产生的,都要把反应条件标注成“点燃”。不能将“燃烧”和“点燃”两个概念混淆。“燃烧”是一种反应现象,如同发光、放热、生成沉淀一样,不是一种反应条件。
1. ①$Mg+O_{2}\overset{ 点燃}{=}MgO_{2}$;②$H_{2}+O_{2}\overset{ 点燃}{=}H_{2}O$
上述两个化学方程式的书写均不对,请写出书写化学方程式应该遵循的原则,并改正上述化学方程式。
2. 配平时,为什么不能改动化学式中元素符号右下角的数字?
3. 确定化学式前的化学计量数的方法有哪些?怎样判断化学方程式是否配平?
归纳总结
1. 配平化学方程式的方法。
(1) 最小公倍数法。
找出式子两边各出现一次,且原子个数不相等又相差较大的元素,求出其原子个数的最小公倍数,用最小公倍数分别除以含有该元素的化学式中该元素的原子个数,确定该物质的化学计量数,并加以配平。
(2) 奇偶配平法(以过氧化氢制氧气:$H_{2}O_{2}\overset{MnO_{2}}{ --}H_{2}O+O_{2}$为例)。
① 找出式子左右两端出现次数较多的元素(式子左、右两边出现次数最多的元素是氧元素)。
② 该元素的原子在两端的总数若是一奇一偶,则选定这一元素作为配平的起点,将其配成偶数(式子左边的氧原子个数为偶数,而右边$H_{2}O$的氧原子个数为奇数,因此将水分子数配成偶数)。
③ 由已推出的化学计量数得出其他化学式的化学计量数(再配平其他的元素)。
(3) 定一法。
① 设某物质的化学计量数为$1$。选择化学方程式中最复杂的化学式,设其化学计量数为$1$。
② 推导其他物质的化学计量数。根据质量守恒定律,即化学反应前后原子的种类和个数不变,通过比较反应前后各元素的原子个数,推导出其他物质的化学计量数。
③ 化为整数。最后将分数形式的化学计量数化为整数,确保化学方程式两边的原子个数相等。
2. 化学方程式书写注意事项。
(1) 书写注意事项。

(2) 正确区分“加热”“点燃”与“高温”等反应条件。
① “加热”与“高温”。“加热”常用“△”号表示,一般指温度在常温以上,$800^{\circ}C$以下。若加热时温度高于$800^{\circ}C$,通常称为“高温”。
② “点燃”。一般认为有燃烧现象产生的,都要把反应条件标注成“点燃”。不能将“燃烧”和“点燃”两个概念混淆。“燃烧”是一种反应现象,如同发光、放热、生成沉淀一样,不是一种反应条件。
答案:
1.提示 书写化学方程式应遵守的原则:一是必须以客观事实为基础,上述反应①中把生成物氧化镁的化学式写成“MgO₂”,违背了客观事实,应写为2Mg+O₂ 点燃==== 2MgO;二是要遵循质量守恒定律,上述反应②中等号两边原子数目不相等,违背了质量守恒定律,应写为2H₂+O₂ 点燃==== 2H₂O。
2.提示 配平时,要遵守客观事实,化学式是由物质结构决定的,不能随意更改物质的化学式。
3.提示 确定化学计量数的方法有最小公倍数法、奇数配偶法、定一法等。若反应前后各种原子的数目相等,说明化学方程式已配平。
2.提示 配平时,要遵守客观事实,化学式是由物质结构决定的,不能随意更改物质的化学式。
3.提示 确定化学计量数的方法有最小公倍数法、奇数配偶法、定一法等。若反应前后各种原子的数目相等,说明化学方程式已配平。
查看更多完整答案,请扫码查看


