2025年暑假作业明天出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业明天出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 某化学兴趣小组为探究${SO_{2}}$的性质,按下图装置进行实验。[已知:${Na_{2}SO_{3} + H_{2}SO_{4}}$(浓)${\xlongequal{}Na_{2}SO_{4} + SO_{2}\uparrow + H_{2}O}$]
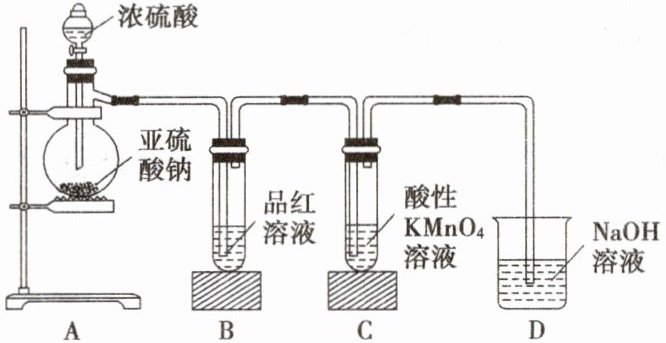
(1)装置B中的实验现象是什么?说明${SO_{2}}$具有什么性质?
(2)装置C中的实验现象是什么?说明${SO_{2}}$具有什么性质?
(3)装置D中${NaOH}$溶液的作用是什么?写出反应的离子方程式。

(1)装置B中的实验现象是什么?说明${SO_{2}}$具有什么性质?
(2)装置C中的实验现象是什么?说明${SO_{2}}$具有什么性质?
(3)装置D中${NaOH}$溶液的作用是什么?写出反应的离子方程式。
答案:
(1)品红溶液褪色,说明SO₂具有漂白性。
(2)酸性KMnO₄溶液的紫红色褪色,说明SO₂具有还原性。
(3)吸收多余的SO₂,以防污染环境。SO₂+2OH⁻=SO₃²⁻+H₂O。
(1)品红溶液褪色,说明SO₂具有漂白性。
(2)酸性KMnO₄溶液的紫红色褪色,说明SO₂具有还原性。
(3)吸收多余的SO₂,以防污染环境。SO₂+2OH⁻=SO₃²⁻+H₂O。
2. 浓硫酸与蔗糖的反应中,表现了浓硫酸的哪些性质?
答案:
表现了浓硫酸的脱水性和强氧化性。
3. 铜与浓硫酸反应的实验中,如何证明${H_{2}SO_{4}}的还原产物是{SO_{2}}$?哪些措施可以减少(或消除)${SO_{2}}$对环境的污染?
答案:
将产生的气体通入品红溶液中,若品红溶液褪色,加热后又会恢复红色,则证明产生的气体是SO₂。用可抽动的铜丝代替铜片,可控制反应的进行,从而减少SO₂的产生量;多余的SO₂可用NaOH溶液吸收,以免污染环境。
4. 浓硫酸有强氧化性,常温下应如何储运浓硫酸?
答案:
因常温下,浓H₂SO₄能使Fe、Al“钝化”,故可用铝槽(或铁罐)车储运浓硫酸。
例1 下列说法正确的是 (
A.因为${SO_{2}}$具有漂白性,所以它能使品红溶液、溴水、${KMnO_{4}(H^{+})}$、石蕊溶液褪色
B.能使品红溶液褪色的不一定是${SO_{2}}$
C.${SO_{2}}$、漂白粉、活性炭、${Na_{2}O_{2}}$都能使红墨水褪色,其原理相同
D.等物质的量的${SO_{2}}和{Cl_{2}}$相遇在溶液中具有漂白能力
B
)A.因为${SO_{2}}$具有漂白性,所以它能使品红溶液、溴水、${KMnO_{4}(H^{+})}$、石蕊溶液褪色
B.能使品红溶液褪色的不一定是${SO_{2}}$
C.${SO_{2}}$、漂白粉、活性炭、${Na_{2}O_{2}}$都能使红墨水褪色,其原理相同
D.等物质的量的${SO_{2}}和{Cl_{2}}$相遇在溶液中具有漂白能力
答案:
解析:这道题是对有漂白性物质的漂白原理的综合考查。要正确解答本题,必须清楚常见漂白剂的漂白原理:Cl₂、Na₂O₂、H₂O₂、O₃等是因强氧化性而具有漂白性;SO₂是能和有机色质化合成无色物质;活性炭是因吸附有机色质而具有漂白性。A选项中SO₂使溴水、酸性KMnO₄溶液褪色是因为SO₂具有还原性,能使品红溶液褪色是因其具有漂白性,SO₂不能使指示剂褪色,所以A选项错误;B选项正确,因为能使品红溶液褪色的物质很多,不仅仅是SO₂;C选项错误,因为这些漂白剂的漂白原理不相同,SO₂漂白属于化合型,活性炭属于吸附型,漂白粉、Na₂O₂属于氧化型;D选项也不正确,等物质的量的SO₂和Cl₂相遇在溶液中反应生成H₂SO₄和HCl,从而失去漂白能力。答案:B
例2 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 (
A.上下移动①中铜丝可控制${SO_{2}}$的量
B.②中选用品红溶液验证${SO_{2}}$的生成
C.③中选用${NaOH}溶液吸收多余的{SO_{2}}$
D.为确认${CuSO_{4}}$生成,向①中加水,观察颜色
D
)A.上下移动①中铜丝可控制${SO_{2}}$的量
B.②中选用品红溶液验证${SO_{2}}$的生成
C.③中选用${NaOH}溶液吸收多余的{SO_{2}}$
D.为确认${CuSO_{4}}$生成,向①中加水,观察颜色
答案:
解析:因为①中含有大量浓硫酸,所以应该冷却后把①中上层溶液慢慢倒入盛有水的烧杯中,D错误。答案:D
查看更多完整答案,请扫码查看


