2025年暑假作业明天出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业明天出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
6. Se、Br 两种元素的部分信息如图所示,下列说法正确的是(
A.原子半径:$Br>Se>P$
B.还原性:$S^{2-}>Se^{2-}>Br^{-}$
C.Se 在元素周期表中位于第四周期ⅥA 族
D.Se、Br 位于同一主族
C
)A.原子半径:$Br>Se>P$
B.还原性:$S^{2-}>Se^{2-}>Br^{-}$
C.Se 在元素周期表中位于第四周期ⅥA 族
D.Se、Br 位于同一主族
答案:
6.C 由图示信息可知Se为34号元素,Br为35号元素,Se和Br位于同一周期且Se位于Br的左侧,原子半径Se>Br,故A、D项错误;Se和S位于同一主族,且Se位于S的下一周期,故还原性Se²⁻>S²⁻,B项错误;由图示信息可知Se位于第四周期ⅥA族,C正确。
7. 利用元素周期表,我们可以认识更多元素的性质。
(1)根据元素周期表来比较 Mg 和 Cs 的金属性,要通过另一种元素作中介或桥梁进行比较,这种元素是
(2)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据元素周期表对角线规则,金属 Be 单质及其化合物的性质与铝单质及其化合物的性质相似。
①已知$2Al+2NaOH+2H_{2}O= 2NaAlO_{2}+3H_{2}\uparrow $,写出 Be 与 NaOH 溶液反应的离子方程式:
②鉴别$Be(OH)_{2}和Mg(OH)_{2}$可选用的试剂为
(3)元素周期表中某一元素具有如下性质:
①该元素单质常被用作半导体材料。
②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气。
③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液。
④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应。在与盐酸反应时,1 mol 这种最高价氧化物对应的水化物最多消耗$4mol\cdot L^{-1}$的盐酸 1 L。
请你写出这种元素在周期表中的位置:
(1)根据元素周期表来比较 Mg 和 Cs 的金属性,要通过另一种元素作中介或桥梁进行比较,这种元素是
Na或Ba
(填元素符号)。(2)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据元素周期表对角线规则,金属 Be 单质及其化合物的性质与铝单质及其化合物的性质相似。
①已知$2Al+2NaOH+2H_{2}O= 2NaAlO_{2}+3H_{2}\uparrow $,写出 Be 与 NaOH 溶液反应的离子方程式:
Be+2OH⁻=BeO₂²⁻+H₂↑
。②鉴别$Be(OH)_{2}和Mg(OH)_{2}$可选用的试剂为
NaOH溶液
。(3)元素周期表中某一元素具有如下性质:
①该元素单质常被用作半导体材料。
②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气。
③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液。
④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应。在与盐酸反应时,1 mol 这种最高价氧化物对应的水化物最多消耗$4mol\cdot L^{-1}$的盐酸 1 L。
请你写出这种元素在周期表中的位置:
第四周期第ⅣA族
。
答案:
7.解析:
(1)比较元素的性质,可通过相邻元素进行比较,所以需要Na或Ba作中介。
(2)根据质量守恒定律,可写出铍与NaOH溶液反应的离子方程式:Be+2OH⁻=BeO₂²⁻+H₂↑。
(3)由①可知,该元素位于元素周期表金属元素与非金属元素分界线附近;由②知,该元素属于非金属元素;由③、④知,该元素既具有金属性,又具有非金属性,且由④知,元素的最高正化合价为+4价。因此,该元素位于金属与非金属元素分界线附近为非金属元素,位于ⅣA族,该元素为Ge元素。答案:
(1)Na或Ba
(2)①Be+2OH⁻=BeO₂²⁻+H₂↑ ②NaOH溶液
(3)第四周期第ⅣA族
(1)比较元素的性质,可通过相邻元素进行比较,所以需要Na或Ba作中介。
(2)根据质量守恒定律,可写出铍与NaOH溶液反应的离子方程式:Be+2OH⁻=BeO₂²⁻+H₂↑。
(3)由①可知,该元素位于元素周期表金属元素与非金属元素分界线附近;由②知,该元素属于非金属元素;由③、④知,该元素既具有金属性,又具有非金属性,且由④知,元素的最高正化合价为+4价。因此,该元素位于金属与非金属元素分界线附近为非金属元素,位于ⅣA族,该元素为Ge元素。答案:
(1)Na或Ba
(2)①Be+2OH⁻=BeO₂²⁻+H₂↑ ②NaOH溶液
(3)第四周期第ⅣA族
8. 下表为元素周期表中的一部分。
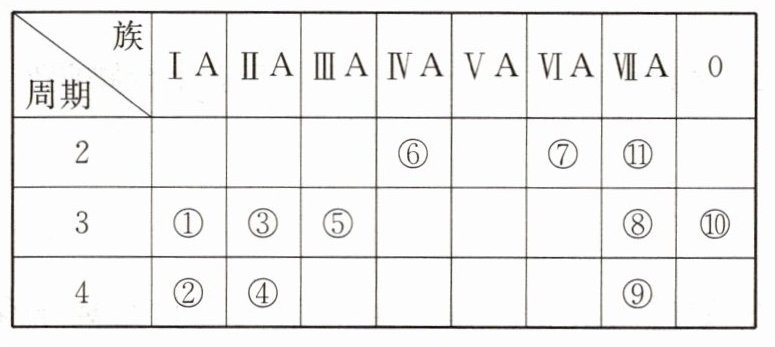
用化学式或元素符号回答下列问题。
(1)①③⑤中,最高价氧化物对应的水化物,碱性最强的是____
(2)②③④中形成的简单离子半径由大到小的顺序是____
(3)①和⑨的最高价氧化物对应水化物的化学式为____
(4)⑧⑨⑪三种元素形成的气态氢化物最稳定的是____

用化学式或元素符号回答下列问题。
(1)①③⑤中,最高价氧化物对应的水化物,碱性最强的是____
NaOH
。(2)②③④中形成的简单离子半径由大到小的顺序是____
K⁺>Ca²⁺>Mg²⁺
。(3)①和⑨的最高价氧化物对应水化物的化学式为____
NaOH
和____HBrO₄
。①和⑨两元素形成化合物的化学式为____NaBr
,该化合物的溶液与元素⑧的单质反应的离子方程式为____Cl₂+2Br⁻=Br₂+2Cl⁻
。(4)⑧⑨⑪三种元素形成的气态氢化物最稳定的是____
HF
,三者非金属性的强弱顺序为____F>Cl>Br
。
答案:
8.
(1)NaOH
(2)K⁺>Ca²⁺>Mg²⁺
(3)NaOH HBrO₄ NaBr Cl₂+2Br⁻=Br₂+2Cl⁻
(4)HF F>Cl>Br
(1)NaOH
(2)K⁺>Ca²⁺>Mg²⁺
(3)NaOH HBrO₄ NaBr Cl₂+2Br⁻=Br₂+2Cl⁻
(4)HF F>Cl>Br
查看更多完整答案,请扫码查看


