2025年暑假作业明天出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业明天出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 核外电子是分层排布的,共划分为几层? 按能量由低到高、离核由近及远的排列顺序是什么? 其中 M 层和 N 层哪一层能量更高?
答案:
提示:7;K、L、M、N、O、P、Q;N层能量高于M层。
2. M 电子层最多可容纳 18 个电子,为什么钾原子的核外电子排布不是 而是
而是 ?
?
 而是
而是 ?
?
答案:
提示:若钾原子的M层排布9个电子,此时M层就成为最外层,这和电子排布规律中"最外层电子数不超过8个"相矛盾,不符合电子排布规律。
3. 随着原子序数的递增,第二周期元素的最高正价是逐渐递增的吗?
答案:
提示:不是;因为F无正价,O无最高正价。
4. A、B 在元素周期表中的位置如图所示。试比较短周期主族元素 A、B 原子半径的大小。
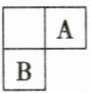

答案:
提示:设空格内的元素为X,则原子半径:r(B)>r(X)>r(A),即B的原子半径大于A的原子半径。
5. 如何通过实验证明$H_{3}PO_{4}的酸性强于H_{2}SiO_{3}$。
答案:
提示:向Na₂SiO₃溶液中加入H₃PO₄溶液,产生白色浑浊,则证明H₃PO₄的酸性强于H₂SiO₃。
6. 试根据同周期元素非金属性的变化规律,比较$SiH_{4}$、$PH_{3}$、$H_{2}S$和 HCl 的稳定性。
答案:
提示:元素的非金属性越强,气态氢化物越稳定。同周期元素,随着原子序数的递增,非金属性逐渐增强,故非金属性Si<P<S<Cl,所以它们氢化物的稳定性顺序为SiH₄<PH₃<H₂S<HCl。
7. 请从原子结构变化的角度解释,同周期元素随着原子序数的递增,金属性减弱、非金属性增强的原因。
答案:
提示:因同周期元素原子的电子层数相同,但原子序数依次增大,核电荷数依次增多,原子核对最外层电子的吸引能力依次增强,原子失电子能力依次减弱,得电子能力依次增强,即元素的金属性依次减弱,非金属性依次增强。
8. 结合元素周期律分析,在现有元素中金属性和非金属性最强的分别是什么元素?
答案:
提示:由元素周期律可知,同一周期从左到右,金属性逐渐减弱,非金属性逐渐增强;同一主族自上而下,金属性逐渐增强,非金属性逐渐减弱。所以金属性最强的元素位于元素周期表的左下角,非金属性最强的元素位于元素周期表的右上角,即金属性最强的应该为钫元素,但由于钫是放射性元素,在自然界中不能稳定存在,所以一般认为铯的金属性最强,氟的非金属性最强。
9. 从第ⅢA 族的硼到第ⅦA 族的砹连成一条斜线,即为金属元素和非金属元素的分界线,分界线附近元素的性质有何特点? 这些元素可制取什么材料?
答案:
提示:分界线附近的元素既有一定的金属性,又有一定的非金属性,这些元素可以制作半导体材料。
查看更多完整答案,请扫码查看


