2025年实验班提优训练暑假衔接版八升九科学浙教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年实验班提优训练暑假衔接版八升九科学浙教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
20. 我国目前使用的燃料主要是煤和石油,这些燃料的燃烧会给环境带来诸多负面影响。
(1)煤和石油等燃料的燃烧会产生大量的二氧化碳气体,加上植被减少等原因,使大气中的二氧化碳气体增多,导致______加剧;含硫的煤和石油的燃烧,会产生大量${SO_{2}}$等酸性气体,不仅污染空气,而且容易形成______,进而污染水体和土壤。
(2)某火力发电厂每天燃烧含硫1.6%的煤100t,若煤中的硫全部转化为${SO_{2}}$,则该厂每天产生${SO_{2}}$______t。
(3)国家标准规定工业废气中${SO_{2}}的含量不得超过1.5×10^{-4}g/m^{3}$。工业上测量${SO_{2}}$的含量时,可以根据反应:${SO_{2} + 2H_{2}O + I_{2}\xlongequal{}H_{2}SO_{4} + 2HI}$。现取该厂废气样品$1m^{3}$,与含碘$5.08×10^{-4}g$的碘液恰好完全反应。试判断该厂排放的废气中${SO_{2}}$含量是否符合国家标准。
(1)煤和石油等燃料的燃烧会产生大量的二氧化碳气体,加上植被减少等原因,使大气中的二氧化碳气体增多,导致______加剧;含硫的煤和石油的燃烧,会产生大量${SO_{2}}$等酸性气体,不仅污染空气,而且容易形成______,进而污染水体和土壤。
(2)某火力发电厂每天燃烧含硫1.6%的煤100t,若煤中的硫全部转化为${SO_{2}}$,则该厂每天产生${SO_{2}}$______t。
(3)国家标准规定工业废气中${SO_{2}}的含量不得超过1.5×10^{-4}g/m^{3}$。工业上测量${SO_{2}}$的含量时,可以根据反应:${SO_{2} + 2H_{2}O + I_{2}\xlongequal{}H_{2}SO_{4} + 2HI}$。现取该厂废气样品$1m^{3}$,与含碘$5.08×10^{-4}g$的碘液恰好完全反应。试判断该厂排放的废气中${SO_{2}}$含量是否符合国家标准。
答案:
(1)温室效应 酸雨
(2)3.2
(3)符合
(1)温室效应 酸雨
(2)3.2
(3)符合
21. 为了保护生态环境,针对全球气候变化,中国政府向全球承诺,力争于2060年前实现“碳中和”。“碳中和”是指在一定时间内,使二氧化碳的排放总量与吸收总量平衡,实现“零排放”。实现“碳中和”通常可采取如下措施:
Ⅰ. 碳转化:指二氧化碳的资源化利用。
Ⅱ. 碳减排:减少人类生产和生活中二氧化碳的排放量。
(1)下列做法不能实现“碳减排”的是______(填字母)。
A. 加高烟囱排放工业废气
B. 推进新能源汽车使用
C. 废弃物分类投放并回收利用
D. 养成节约用水用电习惯
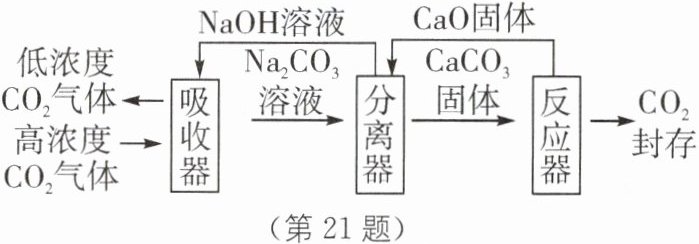
Ⅲ. 碳吸收:①利用植物光合作用,这是自然界消耗二氧化碳的最重要途径;②利用“碳捕捉与封存技术”,即通过一定的方法,将工业生产中产生的${CO_{2}}$分离出来进行储存。在实际生产中,经常用${NaOH}$溶液来“捕捉”${CO_{2}}$,流程如图所示(部分条件及物质未标出)。
(2)用该技术进行“碳捕获”有效利用了原材料,该过程中被循环利用的物质有______。
(3)分离器中发生的反应:①${CaO + H_{2}O\xlongequal{}Ca(OH)_{2}}$,②${Ca(OH)_{2} + Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow + 2NaOH}$。现有溶质质量分数为10.6%的${Na_{2}CO_{3}}$溶液100kg,求完全反应后,理论上可生成${CaCO_{3}}$的质量(要求根据化学方程式计算)。
Ⅰ. 碳转化:指二氧化碳的资源化利用。
Ⅱ. 碳减排:减少人类生产和生活中二氧化碳的排放量。
(1)下列做法不能实现“碳减排”的是______(填字母)。
A. 加高烟囱排放工业废气
B. 推进新能源汽车使用
C. 废弃物分类投放并回收利用
D. 养成节约用水用电习惯
Ⅲ. 碳吸收:①利用植物光合作用,这是自然界消耗二氧化碳的最重要途径;②利用“碳捕捉与封存技术”,即通过一定的方法,将工业生产中产生的${CO_{2}}$分离出来进行储存。在实际生产中,经常用${NaOH}$溶液来“捕捉”${CO_{2}}$,流程如图所示(部分条件及物质未标出)。
(2)用该技术进行“碳捕获”有效利用了原材料,该过程中被循环利用的物质有______。
(3)分离器中发生的反应:①${CaO + H_{2}O\xlongequal{}Ca(OH)_{2}}$,②${Ca(OH)_{2} + Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow + 2NaOH}$。现有溶质质量分数为10.6%的${Na_{2}CO_{3}}$溶液100kg,求完全反应后,理论上可生成${CaCO_{3}}$的质量(要求根据化学方程式计算)。

答案:
(1)A
(2)NaOH、CaO
(3)10kg
(1)A
(2)NaOH、CaO
(3)10kg
查看更多完整答案,请扫码查看


