第69页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
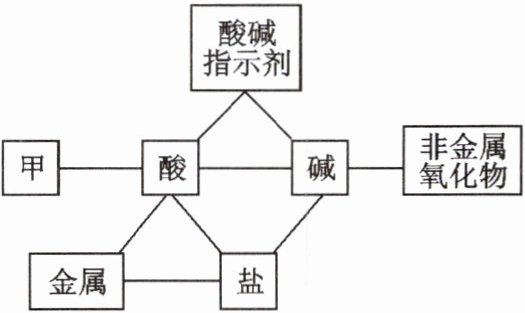
13. 构建思维导图是一种重要的学习方法。请根据酸、碱、盐的化学性质的思维导图,回答下列问题。(“—”表示相连的两类物质之间可以发生反应)
(1)图中甲表示的物质类别是_____ ,写出关系“甲—酸”对应的一条用途:___________ 。
(2)酸与碱作用生成盐和水的反应叫做中和反应。可溶性碱溶液与酸反应时无明显现象,需要加
溶液,证明酸和碱之间发生了化学反应或反应完成。
(3)利用图中“碱—非金属氧化物”的反应,可用氢氧化钠溶液吸收废气中的 (填字母序号)。
A. CO
B. CO₂
C. SO₂
D. N₂
4)工业上用纯碱制取烧碱的反应是图中盐和 (填物质类别)的反应关系。
(5)农业上用波尔多液作杀虫剂,波尔多液的配制是将熟石灰和硫酸铜溶液混合,制得悬浊液,用化学方程式解释该反应过程: 。
(6)图中涉及的复分解反应有____种。
(1)图中甲表示的物质类别是_____ ,写出关系“甲—酸”对应的一条用途:___________ 。
(2)酸与碱作用生成盐和水的反应叫做中和反应。可溶性碱溶液与酸反应时无明显现象,需要加

溶液,证明酸和碱之间发生了化学反应或反应完成。
(3)利用图中“碱—非金属氧化物”的反应,可用氢氧化钠溶液吸收废气中的 (填字母序号)。
A. CO
B. CO₂
C. SO₂
D. N₂
4)工业上用纯碱制取烧碱的反应是图中盐和 (填物质类别)的反应关系。
(5)农业上用波尔多液作杀虫剂,波尔多液的配制是将熟石灰和硫酸铜溶液混合,制得悬浊液,用化学方程式解释该反应过程: 。
(6)图中涉及的复分解反应有____种。

答案:
金属氧化物@@金属除锈(合理即可)@@酚酞@@BC@@碱@@Ca(OH)₂ + CuSO₄ = Cu(OH)₂↓ + CaSO₄@@4
14. 化学兴趣小组的同学欲对贝壳的成分进行探索研究。
【提出问题】如何选择装置进行分析测定?
【查阅资料】贝壳的成分与鸡蛋壳相似,主要成分是碳酸钙,其他成分对实验探究的影响忽略不计;稀盐酸具有微弱的挥发性。
【实验探究】
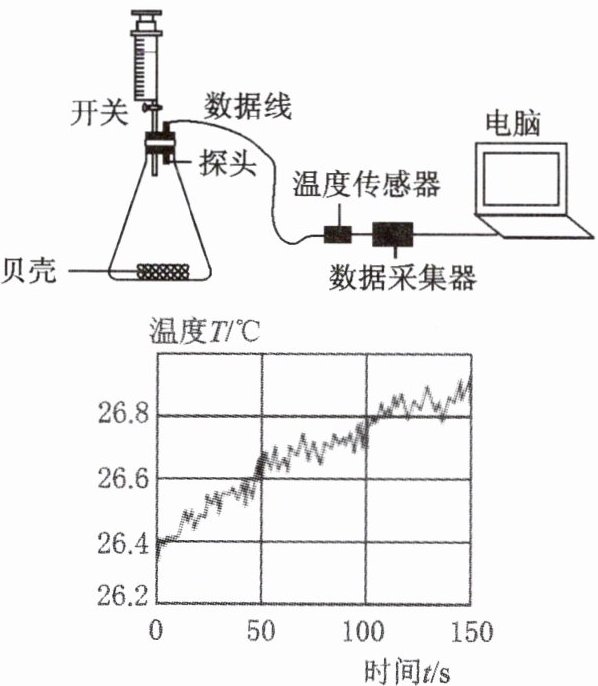
实验一:定性研究
将贝壳洗净、干燥、并研磨成粉末后放入上图所示的锥形瓶中,通过注射器注入稀盐酸,借助数字化实验仪器采集数据。
(1)图中检查装置气密性的方法是:连接仪器,打开开关,通过 ,推知装置的气密性良好。
(2)结合资料,写出贝壳的用途: (写一种)。
(3)由图可知,温度传感器对气体测定结果准确性的影响因素可能有:①随着反应的进行,气体中水蒸气的含量增加;② 。
实验二:定量研究——体积测定
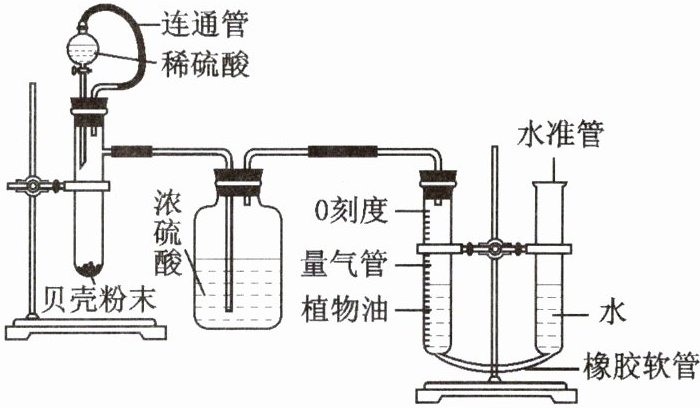
通过测量生成的二氧化碳的体积来计算贝壳中碳酸钙的质量分数,所用仪器如图所示。
资料:量气管有刻度值,且0刻度在上。可以借助橡皮软管上下调节量气管与水准管两边液面的平衡,减少气体体积的测量误差。
(4)图中植物油的作用是 。
(5)其他操作都正确的前提下,若没有“连通管”,测得的碳酸钙含量将 (填“偏大”“不变”或“偏小”)。
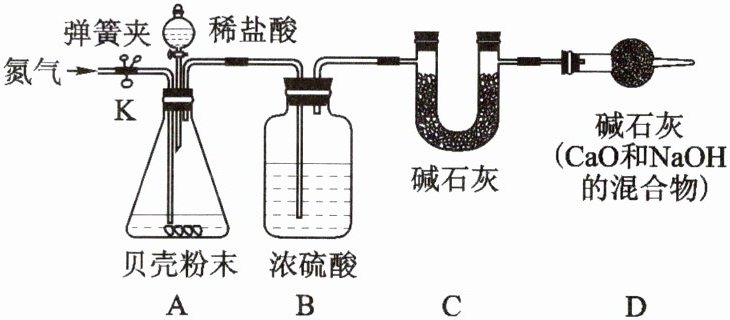
实验三:定量研究——质量测定
通过测量生成的二氧化碳的质量来计算12.5 g贝壳样品中碳酸钙的质量分数,所用仪器如图所示。
(6)该实验反应前后均需要通一段时间的氮气,实验前通氮气的目的是 。
(7)实验前后C装置增重了4.4 g,则该贝壳样品中碳酸钙的百分含量是多少?(要求写出详细的计算过程)
【提出问题】如何选择装置进行分析测定?
【查阅资料】贝壳的成分与鸡蛋壳相似,主要成分是碳酸钙,其他成分对实验探究的影响忽略不计;稀盐酸具有微弱的挥发性。
【实验探究】

实验一:定性研究
将贝壳洗净、干燥、并研磨成粉末后放入上图所示的锥形瓶中,通过注射器注入稀盐酸,借助数字化实验仪器采集数据。
(1)图中检查装置气密性的方法是:连接仪器,打开开关,通过 ,推知装置的气密性良好。
(2)结合资料,写出贝壳的用途: (写一种)。
(3)由图可知,温度传感器对气体测定结果准确性的影响因素可能有:①随着反应的进行,气体中水蒸气的含量增加;② 。
实验二:定量研究——体积测定

通过测量生成的二氧化碳的体积来计算贝壳中碳酸钙的质量分数,所用仪器如图所示。
资料:量气管有刻度值,且0刻度在上。可以借助橡皮软管上下调节量气管与水准管两边液面的平衡,减少气体体积的测量误差。
(4)图中植物油的作用是 。
(5)其他操作都正确的前提下,若没有“连通管”,测得的碳酸钙含量将 (填“偏大”“不变”或“偏小”)。
实验三:定量研究——质量测定
通过测量生成的二氧化碳的质量来计算12.5 g贝壳样品中碳酸钙的质量分数,所用仪器如图所示。
(6)该实验反应前后均需要通一段时间的氮气,实验前通氮气的目的是 。
(7)实验前后C装置增重了4.4 g,则该贝壳样品中碳酸钙的百分含量是多少?(要求写出详细的计算过程)

答案:
1)推(或拉)注射器活塞,活塞能回到原位 (2)可以用于制作补钙剂(合理即可) (3)挥发出的氯化氢气体的含量增多 (4)防止二氧化碳溶于水及与水反应 (5)偏大 (6)排尽装置内的空气,防止空气对实验结果的影响 (7)解:设贝壳样品中碳酸钙的质量为x。 CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑ 100 44 x 4.4 g \(\frac{100}{x}=\frac{44}{4.4 g}\) x = 10 g \(\frac{10 g}{12.5 g}\times100\% = 80\%\) 答:贝壳样品中碳酸钙的质量分数为80%。 [解析](1)检查装置的气密性:连接仪器,打开开关,推(或拉)注射器活塞,如果装置气密性良好,松手后,活塞会回到原位。 (2)贝壳的主要成分是碳酸钙,含钙元素,可应用于制作补钙剂。 (3)由图可知,反应过程中温度升高,会导致气体中水蒸气的含量增加,且稀盐酸具有一定的挥发性,温度越高,挥发得越快,同时会导致挥发出的氯化氢气体的含量增多,从而对气体测定结果的准确性产生影响。 (4)二氧化碳能溶于水,且能与水反应,故植物油的作用是:防止二氧化碳溶于水及与水反应。 (5)如果没有连通器,加入的稀硫酸占据了一定的体积,会导致测得二氧化碳的体积偏大,计算得出的碳酸钙的质量偏大,测得的碳酸钙含量将偏大。 (6)实验前,可将装置内空气排尽,防止空气对实验结果的影响。
查看更多完整答案,请扫码查看


