第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1. 溶液的稀释
将 20 g 溶质质量分数为 20%的 KNO₃溶液加水稀释成 10%的溶液,需加水多少?
将 20 g 溶质质量分数为 20%的 KNO₃溶液加水稀释成 10%的溶液,需加水多少?
答案:
(20 g×20%)÷10% - 20 g = 20 g
答:需加水 20 g。
[解析]溶液稀释前后,溶质的质量不变。原溶液中溶质的质量为:20 g×20% = 4 g,稀释后的溶液质量为:4 g÷10% = 40 g,则需加入水的质量为:40 g - 20 g = 20 g。
2. 溶液的浓缩
将 20 g 氯化钠溶液的溶质质量分数由 10%增至 20%,可采用两种方法:
(1)若采用蒸发溶剂的方法,应蒸发掉______g 水。
(2)若采用加溶质的方法,应再加入______g 氯化钠。
将 20 g 氯化钠溶液的溶质质量分数由 10%增至 20%,可采用两种方法:
(1)若采用蒸发溶剂的方法,应蒸发掉______g 水。
(2)若采用加溶质的方法,应再加入______g 氯化钠。
答案:
10@@2.5@@[解析]
(1)蒸发浓缩时,溶质的质量不变,即为:20 g×10% = 2 g,浓缩后溶液的质量为:2 g÷20% = 10 g,则需蒸发水的质量为:20 g - 10 g = 10 g。
(2)设增加溶质的质量为 x,则[(20 g×10% + x)÷(20 g + x)]×100% = 20%,解得 x = 2.5 g。
(1)蒸发浓缩时,溶质的质量不变,即为:20 g×10% = 2 g,浓缩后溶液的质量为:2 g÷20% = 10 g,则需蒸发水的质量为:20 g - 10 g = 10 g。
(2)设增加溶质的质量为 x,则[(20 g×10% + x)÷(20 g + x)]×100% = 20%,解得 x = 2.5 g。
3. 溶液的混合
将 50 g 溶质质量分数为 10%的氯化钠溶液与 50 g 溶质质量分数为 20%的氯化钠溶液混合,求混合后溶液中溶质的质量分数。
将 50 g 溶质质量分数为 10%的氯化钠溶液与 50 g 溶质质量分数为 20%的氯化钠溶液混合,求混合后溶液中溶质的质量分数。
答案:
$\frac{50 g×10% + 50 g×20%}{50 g + 50 g}$×100% = 15%
答:混合后溶液中溶质的质量分数为 15%。
4. 根据下图所示的实验,完成下列问题:
(1)反应的化学方程式为______________________。
(2)充分反应后,溶液中的溶质为______,溶剂为______,反应过程中,烧杯中______的质量不变。
(3)若 6.5 g 锌与 100 g 稀硫酸恰好完全反应,在这 100 g 稀硫酸中,溶质的质量为____g,溶剂的质量为______g。完全反应后,生成氢气的质量为______g,所得溶液中溶质的质量为______g,溶剂的质量为______g,溶液的质量为______g。
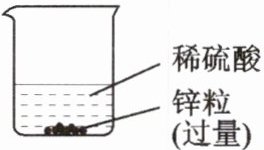
(1)反应的化学方程式为______________________。
(2)充分反应后,溶液中的溶质为______,溶剂为______,反应过程中,烧杯中______的质量不变。
(3)若 6.5 g 锌与 100 g 稀硫酸恰好完全反应,在这 100 g 稀硫酸中,溶质的质量为____g,溶剂的质量为______g。完全反应后,生成氢气的质量为______g,所得溶液中溶质的质量为______g,溶剂的质量为______g,溶液的质量为______g。

答案:
Zn + H₂SO₄ = ZnSO₄ + H₂↑@@ZnSO₄@@H₂O@@H₂O@@9.8@@90.2@@0.2@@16.1@@90.2@@106.3@@[解析]根据化学方程式进行计算,结果为 6.5 g Zn 完全反应后,消耗 H₂SO₄ 的质量为 9.8 g,生成 H₂ 质量为 0.2 g,生成 ZnSO₄ 质量为 16.1 g。参加反应的稀硫酸中溶剂的质量为:100 g - 9.8 g = 90.2 g;所得溶液中的溶质为 ZnSO₄,反应后所得溶液质量为:90.2 g + 16.1 g = 106.3 g。
5. 实验室用溶质质量分数为 5%的过氧化氢溶液和适量二氧化锰混合制取氧气。制取 1.6 g 氧气,需要溶质质量分数为 5%的过氧化氢溶液的质量是多少?
答案:
解:设需要溶质质量分数为 5%的过氧化氢溶液的质量是 x。
2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
68 32
5%x 1.6 g
$\frac{68}{32}$ = $\frac{5%x}{1.6 g}$
x = 68 g
答:需要溶质质量分数为 5%的过氧化氢溶液的质量是 68 g。
6. 化学兴趣小组的同学整理药品时,发现一瓶标签受损的稀盐酸。为测定该稀盐酸的溶质质量分数,同学们进行了下图所示的实验(所选石灰石中的杂质不溶于水,也不与其他物质反应;生成的气体全部逸出)。
(1)生成二氧化碳的质量为____________g。
(2)计算稀盐酸的溶质质量分数(写出计算过程)。

(1)生成二氧化碳的质量为____________g。
(2)计算稀盐酸的溶质质量分数(写出计算过程)。

答案:
4.4@@解:设 100 g 稀盐酸中氯化氢的质量为 x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
73 44
x 4.4 g
$\frac{73}{44}$ = $\frac{x}{4.4 g}$
x = 7.3 g
稀盐酸的溶质质量分数为:$\frac{7.3 g}{100 g}$×100% = 7.3%
答:稀盐酸的溶质质量分数为 7.3%。
7. 向 20 g 铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。
请计算:
(1)合金中锌的质量分数。
(2)所用稀盐酸的溶质质量分数。(计算结果精确到 0.1%)
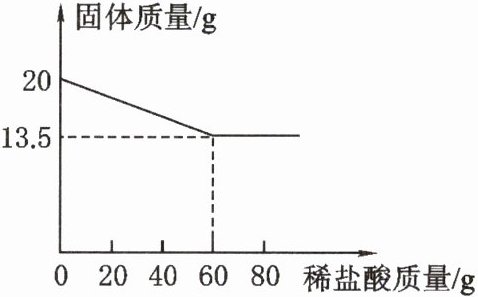
请计算:
(1)合金中锌的质量分数。
(2)所用稀盐酸的溶质质量分数。(计算结果精确到 0.1%)

答案:
(1)合金中锌的质量分数为:$\frac{20 g - 13.5 g}{20 g}$×100% = 32.5%。
(2)解:设稀盐酸中溶质的质量为 x。 参加反应的锌的质量为:20 g - 13.5 g = 6.5 g。 Zn + 2HCl = ZnCl₂ + H₂↑ 65 73 6.5 g x $\frac{65}{73}$ = $\frac{6.5 g}{x}$ x = 7.3 g 稀盐酸的溶质质量分数为:$\frac{7.3 g}{60 g}$×100% ≈ 12.2% 答:稀盐酸的溶质质量分数约为 12.2%。
(1)合金中锌的质量分数为:$\frac{20 g - 13.5 g}{20 g}$×100% = 32.5%。
(2)解:设稀盐酸中溶质的质量为 x。 参加反应的锌的质量为:20 g - 13.5 g = 6.5 g。 Zn + 2HCl = ZnCl₂ + H₂↑ 65 73 6.5 g x $\frac{65}{73}$ = $\frac{6.5 g}{x}$ x = 7.3 g 稀盐酸的溶质质量分数为:$\frac{7.3 g}{60 g}$×100% ≈ 12.2% 答:稀盐酸的溶质质量分数约为 12.2%。
查看更多完整答案,请扫码查看


