第65页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
5. (2024·扬州)葡萄糖酸具有酸性,广泛应用于医药、食品等领域。葡萄糖酸钙可用作钙营养强化剂。
(1)制备葡萄糖酸。葡萄糖与O₂在酶的催化下转化为葡萄糖酸(C₆H₁₂O₇,可用HA表示),制备时向含有酶的葡萄糖溶液中鼓入空气,充分反应后,所得溶液经处理得到HA产品。
①鼓入空气除能提供O₂外,还能起到________作用,促进反应充分进行。
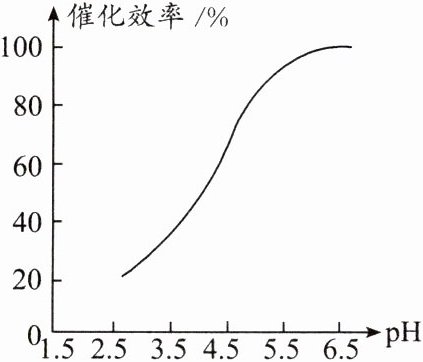
②酶的催化效率与溶液pH的关系如图所示。反应过程中需缓慢添加适量NaOH溶液,作用是______________________________。加入NaOH对产品产生的不利影响是______________________________。
(2)制备葡萄糖酸钙晶体。以贝壳为原料,处理后得到高纯CaCO₃。
Ⅰ. 将CaCO₃与足量HA溶液充分反应,得到葡萄糖酸钙溶液;向其中加入适量无水乙醇,析出大量葡萄糖酸钙晶体(可用CaA₂·H₂O表示)。
①标志CaCO₃与HA反应完全的现象是______________________。
②相同温度下,CaA₂在无水乙醇中的溶解度______CaA₂在水中的溶解度(填“大于”“小于”或“等于”)。
Ⅱ. 煅烧CaCO₃得到CaO;CaO与水反应制得石灰乳,再加入足量HA与其充分反应;将所得溶液蒸发浓缩、冷却结晶,得到CaA₂·H₂O。
①CaCO₃高温分解生成CaO的化学方程式为______________________。
②控制其他条件相同,实验室中取两份相同质量的CaO,分别加入50 mL、70 mL的水制得石灰乳,经与HA反应后,最终所得CaA₂·H₂O的质量如下表所示。根据实验结果,实际生产制备CaA₂·H₂O时,选择向每份质量的CaO中加水50 mL而非70 mL,原因是______________________________。
|实验编号|1|2|
|----|----|----|
|水的体积/mL|50|70|
|CaA₂·H₂O的质量/g|20.5|20.6|
③已知:CaA₂·H₂O的相对分子质量为448。若贝壳中CaCO₃的质量分数为90%,计算100 g贝壳理论上可制得CaA₂·H₂O的质量(写出计算过程)。
(1)制备葡萄糖酸。葡萄糖与O₂在酶的催化下转化为葡萄糖酸(C₆H₁₂O₇,可用HA表示),制备时向含有酶的葡萄糖溶液中鼓入空气,充分反应后,所得溶液经处理得到HA产品。
①鼓入空气除能提供O₂外,还能起到________作用,促进反应充分进行。
②酶的催化效率与溶液pH的关系如图所示。反应过程中需缓慢添加适量NaOH溶液,作用是______________________________。加入NaOH对产品产生的不利影响是______________________________。

(2)制备葡萄糖酸钙晶体。以贝壳为原料,处理后得到高纯CaCO₃。
Ⅰ. 将CaCO₃与足量HA溶液充分反应,得到葡萄糖酸钙溶液;向其中加入适量无水乙醇,析出大量葡萄糖酸钙晶体(可用CaA₂·H₂O表示)。
①标志CaCO₃与HA反应完全的现象是______________________。
②相同温度下,CaA₂在无水乙醇中的溶解度______CaA₂在水中的溶解度(填“大于”“小于”或“等于”)。
Ⅱ. 煅烧CaCO₃得到CaO;CaO与水反应制得石灰乳,再加入足量HA与其充分反应;将所得溶液蒸发浓缩、冷却结晶,得到CaA₂·H₂O。
①CaCO₃高温分解生成CaO的化学方程式为______________________。
②控制其他条件相同,实验室中取两份相同质量的CaO,分别加入50 mL、70 mL的水制得石灰乳,经与HA反应后,最终所得CaA₂·H₂O的质量如下表所示。根据实验结果,实际生产制备CaA₂·H₂O时,选择向每份质量的CaO中加水50 mL而非70 mL,原因是______________________________。
|实验编号|1|2|
|----|----|----|
|水的体积/mL|50|70|
|CaA₂·H₂O的质量/g|20.5|20.6|
③已知:CaA₂·H₂O的相对分子质量为448。若贝壳中CaCO₃的质量分数为90%,计算100 g贝壳理论上可制得CaA₂·H₂O的质量(写出计算过程)。
答案:
(1)①搅拌 ②调节溶液的pH,保证酶的催化效率 引入NaA杂质,降低HA纯度
(2)Ⅰ. ①固体完全溶解,没有气泡产生 ②小于 Ⅱ. ① ②增加20 mL水,产品质量增加不大,且液体过多,结晶时需要蒸发较多的水,不节能(合理答案均可) ③解:设100 g贝壳理论上可制得CaA₂·H₂O的质量为x。
②增加20 mL水,产品质量增加不大,且液体过多,结晶时需要蒸发较多的水,不节能(合理答案均可) ③解:设100 g贝壳理论上可制得CaA₂·H₂O的质量为x。
$CaCO₃ ~ CaA₂·H₂O$
$100$ $448$
$100 g×90%$ $x$
$\frac{448}{100}=\frac{x}{100 g×90%}$
$x = 403.2 g$
答:$100 g$贝壳理论上可制得$CaA₂·H₂O$的质量为$403.2 g$。
(1)①搅拌 ②调节溶液的pH,保证酶的催化效率 引入NaA杂质,降低HA纯度
(2)Ⅰ. ①固体完全溶解,没有气泡产生 ②小于 Ⅱ. ①
 ②增加20 mL水,产品质量增加不大,且液体过多,结晶时需要蒸发较多的水,不节能(合理答案均可) ③解:设100 g贝壳理论上可制得CaA₂·H₂O的质量为x。
②增加20 mL水,产品质量增加不大,且液体过多,结晶时需要蒸发较多的水,不节能(合理答案均可) ③解:设100 g贝壳理论上可制得CaA₂·H₂O的质量为x。 $CaCO₃ ~ CaA₂·H₂O$
$100$ $448$
$100 g×90%$ $x$
$\frac{448}{100}=\frac{x}{100 g×90%}$
$x = 403.2 g$
答:$100 g$贝壳理论上可制得$CaA₂·H₂O$的质量为$403.2 g$。
查看更多完整答案,请扫码查看


