第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
9. 如图是初中化学常用的实验装置,请根据实验要求选择适当的装置并回答相关问题。
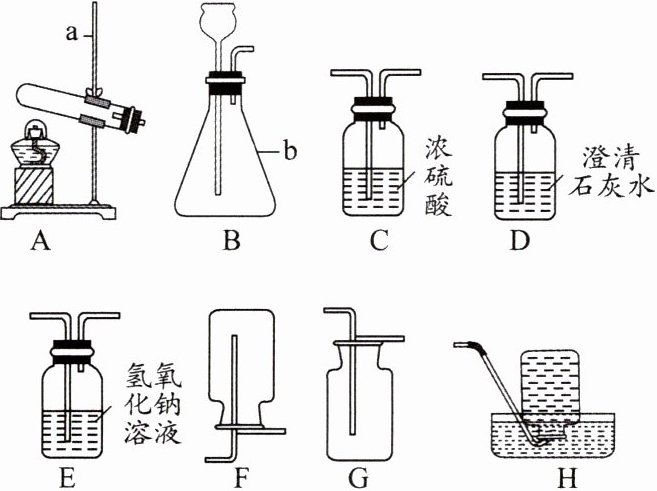
(1)写出编号仪器的名称:a. _______,b. _______。
(2)实验室欲制取并收集干燥的二氧化碳气体,应选用的装置依次为_______→_______→_______(填仪器编号)。将生成的气体通入装置 D,可观察到的现象是______________。
(3)小明借用装置 B 用锌粒和硫酸来制取氢气,发现随着反应的进行,产生气体的速率逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也随之先升高后降低到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积硫酸溶液反应快慢的影响因素”,测得的实验数据如下表所示:
|实验编号|硫酸溶液浓度/%|反应开始时酸溶液的温度/℃|反应前两分钟产生的气体体积/mL|反应结束共产生的气体体积/mL|
|----|----|----|----|----|
|1|10|20|19|118|
|2|15|20|28|175|
|3|10|35|72|118|
|4|15|35|103|175|
①写出锌与硫酸反应的化学方程式:_____________________。
②分析实验数据得出:一定质量的某种金属和同体积硫酸溶液反应时,影响金属和酸反应快慢的主要因素有______________、______________。其中,对照实验 1 和实验 2,可知探究的影响反应速率的因素是**硫酸溶液的浓度**。
③可以通过对比______________(填一项实验数据)来确定金属和酸反应的快慢。
④根据其他测定方法,实验小组的同学绘制了锌粒与硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:0~t s 内,反应速率逐渐加快的主要原因是_____________________;t s 后反应速率逐渐减慢的主要原因是_____________________。


(1)写出编号仪器的名称:a. _______,b. _______。
(2)实验室欲制取并收集干燥的二氧化碳气体,应选用的装置依次为_______→_______→_______(填仪器编号)。将生成的气体通入装置 D,可观察到的现象是______________。
(3)小明借用装置 B 用锌粒和硫酸来制取氢气,发现随着反应的进行,产生气体的速率逐渐加快,一段时间后逐渐减慢,最后停止产生气体。在反应过程中,溶液的温度也随之先升高后降低到室温。于是,小明设计实验来探究“一定质量的某种金属和同体积硫酸溶液反应快慢的影响因素”,测得的实验数据如下表所示:
|实验编号|硫酸溶液浓度/%|反应开始时酸溶液的温度/℃|反应前两分钟产生的气体体积/mL|反应结束共产生的气体体积/mL|
|----|----|----|----|----|
|1|10|20|19|118|
|2|15|20|28|175|
|3|10|35|72|118|
|4|15|35|103|175|
①写出锌与硫酸反应的化学方程式:_____________________。
②分析实验数据得出:一定质量的某种金属和同体积硫酸溶液反应时,影响金属和酸反应快慢的主要因素有______________、______________。其中,对照实验 1 和实验 2,可知探究的影响反应速率的因素是**硫酸溶液的浓度**。
③可以通过对比______________(填一项实验数据)来确定金属和酸反应的快慢。
④根据其他测定方法,实验小组的同学绘制了锌粒与硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:0~t s 内,反应速率逐渐加快的主要原因是_____________________;t s 后反应速率逐渐减慢的主要原因是_____________________。

答案:
(1)铁架台 锥形瓶 (2)B C G 澄清石灰水变浑浊 (3)①$\mathrm{Zn}+\mathrm{H}_{2}\mathrm{SO}_{4}=\mathrm{ZnSO}_{4}+\mathrm{H}_{2}\uparrow$ ②酸的浓度 反应时溶液的温度 酸的浓度 ③前两分钟产生气体的体积 ④该反应为放热反应,温度升高,且温度对反应速率的影响大于硫酸浓度降低对反应速率的影响 反应进行一段时间后,硫酸浓度降低对反应速率的影响大于温度对反应速率的影响
查看更多完整答案,请扫码查看


