第36页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
8. 实现下列变化后,溶液的pH变小的是( )。
A. 稀硫酸与铁粉充分反应
B. 将碳酸饮料瓶盖打开,晃动溶液
C. 往澄清石灰水中不断通入二氧化碳
D. 蒸发氯化钠不饱和溶液使其变饱和
A. 稀硫酸与铁粉充分反应
B. 将碳酸饮料瓶盖打开,晃动溶液
C. 往澄清石灰水中不断通入二氧化碳
D. 蒸发氯化钠不饱和溶液使其变饱和
答案:
C
9. 某学习小组运用传感器探究钙与水的反应,得到相关图像。图甲是反应过程中溶液温度与时间的图像,图乙是反应过程中溶液pH与时间的图像。实验过程中产生大量可燃性气体和少量白色沉淀。下列说法正确的是( )。
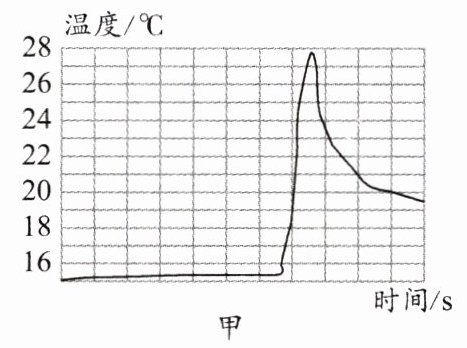
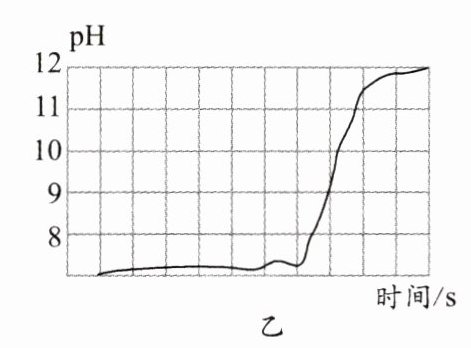
A. 该反应将热能转化为化学能
B. 白色沉淀物为难溶性碳酸钙
C. 钙与水的反应属于置换反应
D. 反应过程中产生大量的氧气,溶液碱性逐渐增强


A. 该反应将热能转化为化学能
B. 白色沉淀物为难溶性碳酸钙
C. 钙与水的反应属于置换反应
D. 反应过程中产生大量的氧气,溶液碱性逐渐增强
答案:
C
10. 体液的pH必须维持在一定的范围内,人体的机能才能得到正常的发挥。下表为几种人体体液的pH范围或近似pH:
|唾液|胃液|血液|小肠液|胆汁|
|----|----|----|----|----|
|6.6~7.1|0.9~1.5|7.35~7.45|7.6|6.8~7.4|
(1)从表中可知,人体不同部位体液的酸碱性 不同 (填“相同”或“不同”)。
(2)从表中可知,人体体液中酸性最强的是 胃液 。
(3)人体血液呈 碱 性。若人体内的CO₂不能通过肺顺利排出体外,则人体血液的pH将会 减小 (填“增大”“减小”或“不变”)。
(4)医生告诉因胃酸过多而引起胃痛的患者,应该少吃葡萄、苹果等水果。由此可推知,葡萄或苹果汁呈 酸 性。
|唾液|胃液|血液|小肠液|胆汁|
|----|----|----|----|----|
|6.6~7.1|0.9~1.5|7.35~7.45|7.6|6.8~7.4|
(1)从表中可知,人体不同部位体液的酸碱性 不同 (填“相同”或“不同”)。
(2)从表中可知,人体体液中酸性最强的是 胃液 。
(3)人体血液呈 碱 性。若人体内的CO₂不能通过肺顺利排出体外,则人体血液的pH将会 减小 (填“增大”“减小”或“不变”)。
(4)医生告诉因胃酸过多而引起胃痛的患者,应该少吃葡萄、苹果等水果。由此可推知,葡萄或苹果汁呈 酸 性。
答案:
不同@@胃液@@碱@@减小@@酸
1. 常见的酸——盐酸、硫酸。
- (1)物理性质:浓盐酸是______色、有______气味的液体,有______性(打开浓盐酸的瓶塞,在瓶口处产生______),有腐蚀性。浓硫酸是一种______色、黏稠的油状液体。
- (2)浓硫酸的特性。
- ①有______性,可用来干燥氢气、______、______等气体,但不能干燥氨气。
- ②有______性,可使纸张、蔗糖变黑炭化。
- ③有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用______冲洗,再用____________
清洗,情况严重者应及时就诊。
- ④与水混合产生大量热,故稀释浓硫酸时,应将______用玻璃棒引流(或沿着烧杯内壁)缓缓注入盛有______的烧杯中,并不断搅拌。切不可把**水**倒入**浓硫酸**里。
- (3)酸的化学性质。
- ①酸能使紫色石蕊溶液变______色,不能使无色酚酞溶液变色。
- ②酸 + 活泼金属→盐 + 氢气。
- a. 镁和稀硫酸:__________________(现象:__________________)。
- b. 锌和稀硫酸:__________________。
- c. 铝和稀盐酸:__________________。
- ③某些金属氧化物 + 酸→盐 + 水。
- a. 氧化铜和稀硫酸:__________________。
- b. 氧化铁和稀盐酸(用于金属除锈):__________________。
- 总结:不同的酸具有通性的原因是__________________;不同的酸具有“个性”的原因是__________________。
- (4)金属活动性顺序及应用。
- ①常见金属活动性顺序:K Ca Na ________ Sn Pb(H)________ Pt Au(金属活动性由强到弱)。
- ②应用:判断金属与酸能否发生置换反应。在金属活动性顺序表中,排在氢________的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢________的金属不能与稀盐酸(或稀硫酸)发生置换反应。
- (5)主要用途。
- ①盐酸:用于金属表面除锈、溶解矿石原料、制药物等。
- ②硫酸和硝酸:制造肥料、药物和炸药。
- ③醋酸:在食品行业中常用作调味剂。
- (1)物理性质:浓盐酸是______色、有______气味的液体,有______性(打开浓盐酸的瓶塞,在瓶口处产生______),有腐蚀性。浓硫酸是一种______色、黏稠的油状液体。
- (2)浓硫酸的特性。
- ①有______性,可用来干燥氢气、______、______等气体,但不能干燥氨气。
- ②有______性,可使纸张、蔗糖变黑炭化。
- ③有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用______冲洗,再用____________
清洗,情况严重者应及时就诊。
- ④与水混合产生大量热,故稀释浓硫酸时,应将______用玻璃棒引流(或沿着烧杯内壁)缓缓注入盛有______的烧杯中,并不断搅拌。切不可把**水**倒入**浓硫酸**里。
- (3)酸的化学性质。
- ①酸能使紫色石蕊溶液变______色,不能使无色酚酞溶液变色。
- ②酸 + 活泼金属→盐 + 氢气。
- a. 镁和稀硫酸:__________________(现象:__________________)。
- b. 锌和稀硫酸:__________________。
- c. 铝和稀盐酸:__________________。
- ③某些金属氧化物 + 酸→盐 + 水。
- a. 氧化铜和稀硫酸:__________________。
- b. 氧化铁和稀盐酸(用于金属除锈):__________________。
- 总结:不同的酸具有通性的原因是__________________;不同的酸具有“个性”的原因是__________________。
- (4)金属活动性顺序及应用。
- ①常见金属活动性顺序:K Ca Na ________ Sn Pb(H)________ Pt Au(金属活动性由强到弱)。
- ②应用:判断金属与酸能否发生置换反应。在金属活动性顺序表中,排在氢________的金属能与稀盐酸(或稀硫酸)发生置换反应,排在氢________的金属不能与稀盐酸(或稀硫酸)发生置换反应。
- (5)主要用途。
- ①盐酸:用于金属表面除锈、溶解矿石原料、制药物等。
- ②硫酸和硝酸:制造肥料、药物和炸药。
- ③醋酸:在食品行业中常用作调味剂。
答案:
(1)无 刺激性 挥发 白雾 无 (2)①吸水 氧气 二氧化碳 ②脱水 ③大量清水 碳酸氢钠溶液 ④浓硫酸 水 水 浓硫酸 (3)①红 ②a. $\mathrm{Mg}+\mathrm{H}_{2}\mathrm{SO}_{4}=\mathrm{MgSO}_{4}+\mathrm{H}_{2}\uparrow$ 镁条不断溶解,表面有大量气泡产生 b. $\mathrm{Zn}+\mathrm{H}_{2}\mathrm{SO}_{4}=\mathrm{ZnSO}_{4}+\mathrm{H}_{2}\uparrow$ c. $2\mathrm{Al}+6\mathrm{HCl}=2\mathrm{AlCl}_{3}+3\mathrm{H}_{2}\uparrow$ ③a. $\mathrm{CuO}+\mathrm{H}_{2}\mathrm{SO}_{4}=\mathrm{CuSO}_{4}+\mathrm{H}_{2}\mathrm{O}$ b. $\mathrm{Fe}_{2}\mathrm{O}_{3}+6\mathrm{HCl}=2\mathrm{FeCl}_{3}+3\mathrm{H}_{2}\mathrm{O}$ 在水溶液中解离出的阳离子都是 $\mathrm{H}^{+}$,构成酸的酸根离子不同 (4)①$\mathrm{Mg}$ $\mathrm{Al}$ $\mathrm{Zn}$ $\mathrm{Fe}$ $\mathrm{Cu}$ $\mathrm{Hg}$ $\mathrm{Ag}$ ②前面 后面
查看更多完整答案,请扫码查看


