第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
9. 化学小组利用图 1 所示装置探究碳酸钙与盐酸的反应。实验开始时,倾斜 Y 形管,使 10 mL 10%盐酸(足量)与 CaCO₃固体充分接触,试管内气压随时间的变化曲线如图 2 所示。
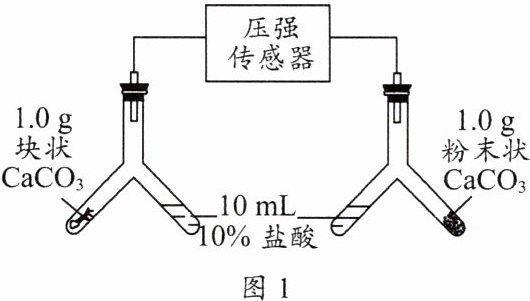

下列有关说法正确的是( )。
A. 反应进行至 t₁ s 时,两支试管中产生的气体的质量都是 0.44 g
B. 用足量稀硫酸代替上述盐酸,所得曲线与图 2 中的相同
C. 相同条件下,粉末状 CaCO₃与盐酸的反应速率比块状的慢
D. 若改用 20%的盐酸进行上述实验,则 t₁ s 时测得的气压大于 p₁ kPa


下列有关说法正确的是( )。
A. 反应进行至 t₁ s 时,两支试管中产生的气体的质量都是 0.44 g
B. 用足量稀硫酸代替上述盐酸,所得曲线与图 2 中的相同
C. 相同条件下,粉末状 CaCO₃与盐酸的反应速率比块状的慢
D. 若改用 20%的盐酸进行上述实验,则 t₁ s 时测得的气压大于 p₁ kPa
答案:
D
10. 海水中含 80 多种元素,是巨大的资源宝库。
Ⅰ. 通过海水晒盐可以得到粗盐,将粗盐进一步提纯可获得化工原料 NaCl。
(1)粗盐中含多种可溶性杂质如(MgCl₂、CaCl₂、Na₂SO₄ 等)及不溶性杂质(如泥沙)。为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH 溶液、②Na₂CO₃ 溶液、③BaCl₂ 溶液,加入试剂的先后顺序不合理的是 (填标号)。
A. ①③② B. ②①③ C. ③②① D. ③①②
(2)过滤后,往滤液中加入 (填试剂名称),调节 pH 至约为 4,再经蒸发结晶可获得精盐。
Ⅱ. 我国制碱工业先驱侯德榜先生改进西方制碱工艺并发明了侯氏制碱法,使氯化钠的利用率大大提高,为纯碱和氮肥工业发展作出了杰出贡献。某学习小组在实验室模拟侯氏制碱法,用精制饱和食盐水、NH₃、CO₂作为原料制取 NaHCO₃,设计的装置如图所示,其中 M、N 分别为实验制备 NH₃、CO₂ 的发生装置。
已知:
①NH₃ 极易溶于水(通常状况下,1 体积水溶解 700 体积 NH₃)。
②20 ℃时,NaCl 的溶解度为 36.0 g,NH₄Cl 的溶解度为 37.2 g,NaHCO₃的溶解度为 9.6 g。

(3)实验开始时,先打开 (填“K₁”或“K₂”),通入一段时间 (填化学式)后,再打开 (填“K₁”或“K₂”)。
(4)图中碳酸氢钠饱和溶液的作用为 。
(5)此过程的化学方程式为:①NH₃ + CO₂ + H₂O = NH₄HCO₃,② 。
(6)复分解反应是初中化学常见的一种基本反应类型。下列与复分解反应有关的说法错误的是 (填标号)。
A. 复分解反应中的物质都是化合物
B. 复分解反应一定具有明显的现象
C. 酸、碱、盐之间不一定发生复分解反应
D. 复分解反应中一定有盐生成
(7)反应结束后,将三颈烧瓶内的混合物过滤后即可获得碳酸氢钠晶体。向滤液中加入食盐细粉后又析出一种晶体,其化学式为 NH₄Cl,该物质在农业上可用作氮肥。再次过滤后的滤液可循环利用,大大提高了 NaCl 的利用率,降低了生产成本。
(8)取 5.00 g 产品,充分受热分解(杂质受热不分解且不与 NaHCO₃ 反应),待冷却至室温后称量,最终得到残留固体 3.45 g。请计算产品中 NaHCO₃ 的纯度(写出计算过程)。
Ⅰ. 通过海水晒盐可以得到粗盐,将粗盐进一步提纯可获得化工原料 NaCl。
(1)粗盐中含多种可溶性杂质如(MgCl₂、CaCl₂、Na₂SO₄ 等)及不溶性杂质(如泥沙)。为除去相应杂质,将粗盐溶于水后再加入稍过量的①NaOH 溶液、②Na₂CO₃ 溶液、③BaCl₂ 溶液,加入试剂的先后顺序不合理的是 (填标号)。
A. ①③② B. ②①③ C. ③②① D. ③①②
(2)过滤后,往滤液中加入 (填试剂名称),调节 pH 至约为 4,再经蒸发结晶可获得精盐。
Ⅱ. 我国制碱工业先驱侯德榜先生改进西方制碱工艺并发明了侯氏制碱法,使氯化钠的利用率大大提高,为纯碱和氮肥工业发展作出了杰出贡献。某学习小组在实验室模拟侯氏制碱法,用精制饱和食盐水、NH₃、CO₂作为原料制取 NaHCO₃,设计的装置如图所示,其中 M、N 分别为实验制备 NH₃、CO₂ 的发生装置。
已知:
①NH₃ 极易溶于水(通常状况下,1 体积水溶解 700 体积 NH₃)。
②20 ℃时,NaCl 的溶解度为 36.0 g,NH₄Cl 的溶解度为 37.2 g,NaHCO₃的溶解度为 9.6 g。

(3)实验开始时,先打开 (填“K₁”或“K₂”),通入一段时间 (填化学式)后,再打开 (填“K₁”或“K₂”)。
(4)图中碳酸氢钠饱和溶液的作用为 。
(5)此过程的化学方程式为:①NH₃ + CO₂ + H₂O = NH₄HCO₃,② 。
(6)复分解反应是初中化学常见的一种基本反应类型。下列与复分解反应有关的说法错误的是 (填标号)。
A. 复分解反应中的物质都是化合物
B. 复分解反应一定具有明显的现象
C. 酸、碱、盐之间不一定发生复分解反应
D. 复分解反应中一定有盐生成
(7)反应结束后,将三颈烧瓶内的混合物过滤后即可获得碳酸氢钠晶体。向滤液中加入食盐细粉后又析出一种晶体,其化学式为 NH₄Cl,该物质在农业上可用作氮肥。再次过滤后的滤液可循环利用,大大提高了 NaCl 的利用率,降低了生产成本。
(8)取 5.00 g 产品,充分受热分解(杂质受热不分解且不与 NaHCO₃ 反应),待冷却至室温后称量,最终得到残留固体 3.45 g。请计算产品中 NaHCO₃ 的纯度(写出计算过程)。
答案:
B@@稀盐酸@@$K_{1}$@@$NH_{3}$@@$K_{2}$@@除去二氧化碳气体中的杂质气体氯化氢@@$NaCl + NH_{4}HCO_{3}=NaHCO_{3}\downarrow + NH_{4}Cl$@@B@@解:设产品中碳酸氢钠的纯度为$x$。

答:产品中$NaHCO_{3}$的纯度为$84\%$。
B@@稀盐酸@@$K_{1}$@@$NH_{3}$@@$K_{2}$@@除去二氧化碳气体中的杂质气体氯化氢@@$NaCl + NH_{4}HCO_{3}=NaHCO_{3}\downarrow + NH_{4}Cl$@@B@@解:设产品中碳酸氢钠的纯度为$x$。

答:产品中$NaHCO_{3}$的纯度为$84\%$。
查看更多完整答案,请扫码查看


