2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
18. 下列离子方程式书写正确的是 ( )
A.大理石与稀硝酸反应:$CO_3^{2-}+2H^+ = CO_2↑+H_2O$
B.碳酸氢钠溶液和过量的澄清石灰水混合:$2HCO_3^-+Ca^{2+}+2OH^- = CaCO_3↓+CO_3^{2-}+2H_2O$
C.少量$SO_2$通入$Ca(ClO)_2$溶液中:$SO_2+H_2O+Ca^{2+}+2ClO^- = CaSO_3↓+2HClO$
D.过量铁粉投入稀硝酸中:$3Fe+8H^++2NO_3^- = 3Fe^{2+}+2NO↑+4H_2O$
A.大理石与稀硝酸反应:$CO_3^{2-}+2H^+ = CO_2↑+H_2O$
B.碳酸氢钠溶液和过量的澄清石灰水混合:$2HCO_3^-+Ca^{2+}+2OH^- = CaCO_3↓+CO_3^{2-}+2H_2O$
C.少量$SO_2$通入$Ca(ClO)_2$溶液中:$SO_2+H_2O+Ca^{2+}+2ClO^- = CaSO_3↓+2HClO$
D.过量铁粉投入稀硝酸中:$3Fe+8H^++2NO_3^- = 3Fe^{2+}+2NO↑+4H_2O$
答案:
18.D 离子方程式正误判断 大理石的主要成分是碳酸钙,书写离子方程式时需用化学式表示,A错误;碳酸氢钠溶液与过量石灰水反应后,溶液中的碳酸根离子均以碳酸钙沉淀的形式存在,B错误;二氧化硫与次氯酸钙发生氧化还原反应,生成硫酸钙沉淀,C错误;过量铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,且题给方程式符合守恒规则,D正确。
方法点拨 与量有关的离子方程式书写方法:第一步,应该判断反应物中哪种物质是少量的,哪种物质是过量的;第二步,假设少量的反应物为$1\ mol$,写出其中参加反应的离子及其系数;第三,由少量的物质中参加反应的离子的量来确定过量物质中参加反应的离子的量,从而写出正确的离子方程式。
方法点拨 与量有关的离子方程式书写方法:第一步,应该判断反应物中哪种物质是少量的,哪种物质是过量的;第二步,假设少量的反应物为$1\ mol$,写出其中参加反应的离子及其系数;第三,由少量的物质中参加反应的离子的量来确定过量物质中参加反应的离子的量,从而写出正确的离子方程式。
19. 关于反应:$10NaN_3+2KNO_3 = K_2O+5Na_2O+16N_2↑$,下列说法正确的是 ( )
A.若有 6.5 g $NaN_3$参加反应,则生成 3.584 L $N_2$
B.$NaN_3$中氮元素为-1 价
C.氧化产物与还原产物的物质的量之比为 15:1
D.若 1 mol $KNO_3$参加反应,转移电子的物质的量为 10 mol
A.若有 6.5 g $NaN_3$参加反应,则生成 3.584 L $N_2$
B.$NaN_3$中氮元素为-1 价
C.氧化产物与还原产物的物质的量之比为 15:1
D.若 1 mol $KNO_3$参加反应,转移电子的物质的量为 10 mol
答案:
19.C 氧化还原反应 没有已知温度和压强,无法计算生成气体的体积,A错误;$NaN_3$中氮元素的平均价态为$-\frac{1}{3}$,B错误;该反应中化合价变化的元素只有氮元素,所以氧化产物和还原产物均为氮气,根据得失电子守恒可知,氧化产物与还原产物的物质的量之比为$15:1$,C正确;$1\ mol$硝酸钾参加反应,转移$5\ mol$电子,D错误。
20. 由一种阳离子与两种酸根阴离子组成的盐称为混盐,$CaOCl_2$是一种常见的混盐。下列说法不正确的是 ( )
A.$CaOCl_2$有较强的氧化性
B.$CaOCl_2$有类似于漂白粉的性质,也是混合物
C.由氯气为原料,每生成 1 mol $CaOCl_2$转移的电子为 1 mol
D.$CaOCl_2$的溶液中加入足量浓硫酸,可有黄绿色的气体产生
A.$CaOCl_2$有较强的氧化性
B.$CaOCl_2$有类似于漂白粉的性质,也是混合物
C.由氯气为原料,每生成 1 mol $CaOCl_2$转移的电子为 1 mol
D.$CaOCl_2$的溶液中加入足量浓硫酸,可有黄绿色的气体产生
答案:
20.B 混盐的性质 $CaOCl_2$由$Ca^{2+}$、$Cl^-$、$ClO^-$构成,具有较强的氧化性,A正确;混盐属于纯净物,B错误;$CaOCl_2$中含有一个$+1$价的氯原子和一个$-1$价的氯原子,所以以氯气为原料,每生成$1\ mol\ CaOCl_2$转移$1\ mol$电子,C正确;$CaOCl_2$中的$ClO^-$在酸性条件下可以氧化氯离子产生黄绿色的氯气,D正确。
21. 合成氨及其衍生物工业是化工生产的重要门类,请结合图示判断下列说法正确的是 ( )
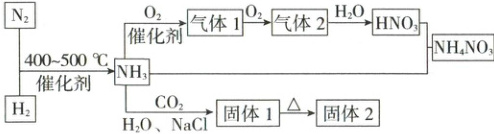
A.湿润的淀粉-KI 试纸可以鉴别气体 2 和溴蒸气
B.饱和 NaCl 溶液中先通入过量$CO_2$再通入过量$NH_3$可以得到固体 1
C.1 L 气体 1、2 的混合气与 1 L $NH_3$在一定条件下转化为对环境无害的物质,混合气中二者的体积比为 1:1
D.气体 2 能与水反应生成$HNO_3$,故气体 2 是酸性氧化物

A.湿润的淀粉-KI 试纸可以鉴别气体 2 和溴蒸气
B.饱和 NaCl 溶液中先通入过量$CO_2$再通入过量$NH_3$可以得到固体 1
C.1 L 气体 1、2 的混合气与 1 L $NH_3$在一定条件下转化为对环境无害的物质,混合气中二者的体积比为 1:1
D.气体 2 能与水反应生成$HNO_3$,故气体 2 是酸性氧化物
答案:
21.C 含氮化合物的性质与转化 氨气与氧气发生催化氧化生成$NO$,即气体1为$NO$,$NO$与氧气反应生成气体2,则气体2为$NO_2$,$NO_2$和溴蒸气均能使湿润的淀粉$-KI$试纸变蓝,所以无法鉴别,A错误;为了得到碳酸氢钠固体,需要溶液中生成大量的$HCO_3^-$,所以应先通入过量的氨气,再通入过量的二氧化碳,B错误;$1\ L\ NO$、$NO_2$的混合气体与$1\ L\ NH_3$恰好反应生成$N_2$,根据得失电子守恒可得,$NO$与$NO_2$混合气体中氮元素的平均价态为$+3$,即$NO$、$NO_2$的体积比为$1:1$,C正确;二氧化氮与水反应生成硝酸和$NO$,不属于酸性氧化物,D错误。
查看更多完整答案,请扫码查看


