2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
18. (12分)某化学兴趣小组甲、乙两位同学为测定Na₂CO₃和NaCl混合物中Na₂CO₃的质量分数,分别进行实验。回答下列问题:
(1)甲同学用如图装置进行测定。
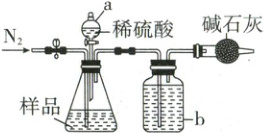
称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N₂,然后关闭弹簧夹,接上总质量为m g的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的N₂,然后取下干燥管称得其质量为n g。
①洗气瓶b中盛放的液体是__________(写名称)。
②锥形瓶中发生反应的离子方程式为________________________。
③第二次通入N₂的目的是________________________。如果没有进行第一次通N₂操作,测量的结果将会__________(填“偏大”“偏小”或“不变”)。
④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?________________________。
(2)乙同学用如图所示方法和步骤进行实验:
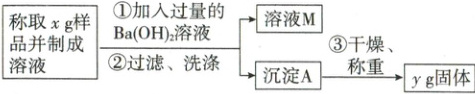
乙同学测得样品中Na₂CO₃的质量分数为__________(用含x和y的代数式表示)。
(1)甲同学用如图装置进行测定。

称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N₂,然后关闭弹簧夹,接上总质量为m g的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的N₂,然后取下干燥管称得其质量为n g。
①洗气瓶b中盛放的液体是__________(写名称)。
②锥形瓶中发生反应的离子方程式为________________________。
③第二次通入N₂的目的是________________________。如果没有进行第一次通N₂操作,测量的结果将会__________(填“偏大”“偏小”或“不变”)。
④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?________________________。
(2)乙同学用如图所示方法和步骤进行实验:

乙同学测得样品中Na₂CO₃的质量分数为__________(用含x和y的代数式表示)。
答案:
18.(12 分,每空 2 分)
(1)①浓硫酸 ②$\mathrm{CO}_{3}^{2 - } + 2\mathrm{H}^{+} = \mathrm{H}_{2} \mathrm{O} + \mathrm{CO}_{2} \uparrow$ ③使反应生成的$\mathrm{CO}_{2}$全部进入干燥管中被碱石灰吸收 ④在干燥管后再接一个装碱石灰的干燥管 (合理即可)
(2)$\frac{106y}{197x} × 100 \%$
物质含量的测定实验
【实验剖析】
实验原理:利用$\mathrm{Na}_{2} \mathrm{CO}_{3}$与稀硫酸反应生成$\mathrm{CO}_{2}$,通过测定$\mathrm{CO}_{2}$的质量来间接计算$\mathrm{Na}_{2} \mathrm{CO}_{3}$的质量分数。
【解析】
(1)①碳酸钠和稀硫酸反应生成二氧化碳,根据碱石灰吸收二氧化碳的质量计算可得$\mathrm{Na}_{2} \mathrm{CO}_{3}$质量,所以洗气瓶b中盛放干燥剂,该液体是浓硫酸,用于干燥二氧化碳。②锥形瓶中碳酸钠和稀硫酸反应生成硫酸钠、二氧化碳、水,发生反应的离子方程式为$\mathrm{CO}_{3}^{2 - } + 2\mathrm{H}^{+} = \mathrm{H}_{2} \mathrm{O} + \mathrm{CO}_{2} \uparrow$。③为提高实验的准确性,第二次通入$\mathrm{N}_{2}$的目的是使反应生成的二氧化碳全部进入干燥管中被碱石灰吸收。如果没有进行第一次通$\mathrm{N}_{2}$操作,空气中的二氧化碳会被碱石灰吸收,则测得二氧化碳质量偏大,最终测量的结果会偏大。④甲同学设计的该实验装置中,碱石灰有可能吸收空气中的二氧化碳和水蒸气,改进的方法是在装碱石灰的干燥管后再接一个装碱石灰的干燥管。
(2)设样品中碳酸钠的质量为$a \mathrm{~g}$;$\mathrm{Na}_{2} \mathrm{CO}_{3} + \mathrm{Ba}(\mathrm{OH})_{2} = \mathrm{BaCO}_{3} \downarrow + 2\mathrm{NaOH}$,$106$ $197$,$a \mathrm{~g}$ $y \mathrm{~g}$,$a = \frac{106y}{197} \mathrm{~g}$,样品中$\mathrm{Na}_{2} \mathrm{CO}_{3}$的质量分数为$\frac{\frac{106y}{197} \mathrm{~g}}{x \mathrm{~g}} × 100 \% = \frac{106y}{197x} × 100 \%$。
(1)①浓硫酸 ②$\mathrm{CO}_{3}^{2 - } + 2\mathrm{H}^{+} = \mathrm{H}_{2} \mathrm{O} + \mathrm{CO}_{2} \uparrow$ ③使反应生成的$\mathrm{CO}_{2}$全部进入干燥管中被碱石灰吸收 ④在干燥管后再接一个装碱石灰的干燥管 (合理即可)
(2)$\frac{106y}{197x} × 100 \%$
物质含量的测定实验
【实验剖析】
实验原理:利用$\mathrm{Na}_{2} \mathrm{CO}_{3}$与稀硫酸反应生成$\mathrm{CO}_{2}$,通过测定$\mathrm{CO}_{2}$的质量来间接计算$\mathrm{Na}_{2} \mathrm{CO}_{3}$的质量分数。
【解析】
(1)①碳酸钠和稀硫酸反应生成二氧化碳,根据碱石灰吸收二氧化碳的质量计算可得$\mathrm{Na}_{2} \mathrm{CO}_{3}$质量,所以洗气瓶b中盛放干燥剂,该液体是浓硫酸,用于干燥二氧化碳。②锥形瓶中碳酸钠和稀硫酸反应生成硫酸钠、二氧化碳、水,发生反应的离子方程式为$\mathrm{CO}_{3}^{2 - } + 2\mathrm{H}^{+} = \mathrm{H}_{2} \mathrm{O} + \mathrm{CO}_{2} \uparrow$。③为提高实验的准确性,第二次通入$\mathrm{N}_{2}$的目的是使反应生成的二氧化碳全部进入干燥管中被碱石灰吸收。如果没有进行第一次通$\mathrm{N}_{2}$操作,空气中的二氧化碳会被碱石灰吸收,则测得二氧化碳质量偏大,最终测量的结果会偏大。④甲同学设计的该实验装置中,碱石灰有可能吸收空气中的二氧化碳和水蒸气,改进的方法是在装碱石灰的干燥管后再接一个装碱石灰的干燥管。
(2)设样品中碳酸钠的质量为$a \mathrm{~g}$;$\mathrm{Na}_{2} \mathrm{CO}_{3} + \mathrm{Ba}(\mathrm{OH})_{2} = \mathrm{BaCO}_{3} \downarrow + 2\mathrm{NaOH}$,$106$ $197$,$a \mathrm{~g}$ $y \mathrm{~g}$,$a = \frac{106y}{197} \mathrm{~g}$,样品中$\mathrm{Na}_{2} \mathrm{CO}_{3}$的质量分数为$\frac{\frac{106y}{197} \mathrm{~g}}{x \mathrm{~g}} × 100 \% = \frac{106y}{197x} × 100 \%$。
19. (15分)按要求完成下列填空:
Ⅰ. 配制220mL 4.0mol/L NaOH溶液的实验步骤如下:
a. 计算需要氢氧化钠固体的质量;
b. 用滤纸称量氢氧化钠固体;
c. 用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d. 用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀;
e. 继续向容量瓶中加蒸馏水至刻线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻线相切;
f. 盖好瓶塞,反复上下颠倒,摇匀;
g. 将配制好的溶液倒入试剂瓶中,并贴好标签。
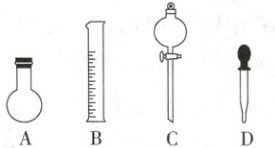
(1)如图所示的仪器中,配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和__________(填仪器名称)。
(2)所需称量的氢氧化钠固体的质量是__________。
(3)配制上述溶液的操作不正确的是__________(填序号)。
(4)配制过程中,其他操作均正确。下列能引起所得溶液浓度偏高的是__________(填序号)。
A. 定容时,俯视刻线
B. 定容摇匀后,发现液面低于刻线,又用胶头滴管滴加蒸馏水至刻线
C. 转移前,发现容量瓶内含有少量蒸馏水
D. 称量时使用的砝码生锈
Ⅱ. 化学实验和科学研究中常需要用一定溶质质量分数的溶液配制一定物质的量浓度的溶液。
(5)现用质量分数为98%、密度为1.84g/cm³的浓硫酸来配制500mL 0.5mol/L的稀硫酸。计算所需浓硫酸的体积为____mL(保留1位小数),现有①10mL ②25mL ③50mL ④100mL四种规格的量筒,你选用的量筒是__________(填代号)。
(6)在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度__________(填“偏大”“偏小”或“无影响”)。
Ⅰ. 配制220mL 4.0mol/L NaOH溶液的实验步骤如下:
a. 计算需要氢氧化钠固体的质量;
b. 用滤纸称量氢氧化钠固体;
c. 用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d. 用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀;
e. 继续向容量瓶中加蒸馏水至刻线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻线相切;
f. 盖好瓶塞,反复上下颠倒,摇匀;
g. 将配制好的溶液倒入试剂瓶中,并贴好标签。
(1)如图所示的仪器中,配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和__________(填仪器名称)。

(2)所需称量的氢氧化钠固体的质量是__________。
(3)配制上述溶液的操作不正确的是__________(填序号)。
(4)配制过程中,其他操作均正确。下列能引起所得溶液浓度偏高的是__________(填序号)。
A. 定容时,俯视刻线
B. 定容摇匀后,发现液面低于刻线,又用胶头滴管滴加蒸馏水至刻线
C. 转移前,发现容量瓶内含有少量蒸馏水
D. 称量时使用的砝码生锈
Ⅱ. 化学实验和科学研究中常需要用一定溶质质量分数的溶液配制一定物质的量浓度的溶液。
(5)现用质量分数为98%、密度为1.84g/cm³的浓硫酸来配制500mL 0.5mol/L的稀硫酸。计算所需浓硫酸的体积为____mL(保留1位小数),现有①10mL ②25mL ③50mL ④100mL四种规格的量筒,你选用的量筒是__________(填代号)。
(6)在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度__________(填“偏大”“偏小”或“无影响”)。
答案:
19.(15 分,除标注外每空 2 分)
(1)AC $250 \mathrm{~mL}$容量瓶 (1 分)
(2)$40.0 \mathrm{~g}$
(3)bc
(4)AD
(5)$13.6$ ②
(6)偏大
一定物质的量浓度溶液的配制
【解析】
(1)配制溶液不需要分液漏斗和烧瓶;配制$220 \mathrm{~mL}$ $4.0 \mathrm{~mol/L} \mathrm{NaOH}$溶液还需用到的玻璃仪器有烧杯、玻璃棒和$250 \mathrm{~mL}$容量瓶。
(2)所需称量的氢氧化钠固体的质量$m = n\mathrm{M} = c\mathrm{V}\mathrm{M} = 4.0 \mathrm{~mol/L} × 0.25 \mathrm{~L} × 40 \mathrm{~g/mol} = 40.0 \mathrm{~g}$。
(3)b.称量氢氧化钠固体不能用滤纸,可以选用烧杯;c.用适量的蒸馏水溶解称量好的氢氧化钠固体,需待溶液冷却至室温再注入容量瓶。
(4)定容时,俯视刻度线,导致加入溶剂的体积偏小,溶液浓度偏高,A 正确;定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度,则所加溶剂体积偏大,浓度偏低,B 错误;转移前,发现容量瓶内含有少量蒸馏水,不影响溶质的质量和溶剂的体积,对所配溶液浓度不产生影响,C 错误;称量时使用的砝码生锈,则所称$\mathrm{NaOH}$的质量偏大,所配溶液的浓度偏高,D 正确。
(5)浓硫酸浓度:$c = \frac{1000 \rho \omega}{\mathrm{M}} = \frac{1000 × 1.84 × 98 \%}{98} \mathrm{~mol/L} = 18.4 \mathrm{~mol/L}$;需要浓硫酸体积:$\mathrm{V} = \frac{0.5 \mathrm{~mol/L} × 500 \mathrm{~mL}}{18.4 \mathrm{~mol/L}} \approx 13.6 \mathrm{~mL}$;量筒规格需略大于量取溶液的体积,选$25 \mathrm{~mL}$量筒。
(6)若用量筒量取浓硫酸时仰视刻度线,则量取的浓硫酸体积偏大,所配溶液浓度偏大。
(解析人:陈褚云)
(1)AC $250 \mathrm{~mL}$容量瓶 (1 分)
(2)$40.0 \mathrm{~g}$
(3)bc
(4)AD
(5)$13.6$ ②
(6)偏大
一定物质的量浓度溶液的配制
【解析】
(1)配制溶液不需要分液漏斗和烧瓶;配制$220 \mathrm{~mL}$ $4.0 \mathrm{~mol/L} \mathrm{NaOH}$溶液还需用到的玻璃仪器有烧杯、玻璃棒和$250 \mathrm{~mL}$容量瓶。
(2)所需称量的氢氧化钠固体的质量$m = n\mathrm{M} = c\mathrm{V}\mathrm{M} = 4.0 \mathrm{~mol/L} × 0.25 \mathrm{~L} × 40 \mathrm{~g/mol} = 40.0 \mathrm{~g}$。
(3)b.称量氢氧化钠固体不能用滤纸,可以选用烧杯;c.用适量的蒸馏水溶解称量好的氢氧化钠固体,需待溶液冷却至室温再注入容量瓶。
(4)定容时,俯视刻度线,导致加入溶剂的体积偏小,溶液浓度偏高,A 正确;定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度,则所加溶剂体积偏大,浓度偏低,B 错误;转移前,发现容量瓶内含有少量蒸馏水,不影响溶质的质量和溶剂的体积,对所配溶液浓度不产生影响,C 错误;称量时使用的砝码生锈,则所称$\mathrm{NaOH}$的质量偏大,所配溶液的浓度偏高,D 正确。
(5)浓硫酸浓度:$c = \frac{1000 \rho \omega}{\mathrm{M}} = \frac{1000 × 1.84 × 98 \%}{98} \mathrm{~mol/L} = 18.4 \mathrm{~mol/L}$;需要浓硫酸体积:$\mathrm{V} = \frac{0.5 \mathrm{~mol/L} × 500 \mathrm{~mL}}{18.4 \mathrm{~mol/L}} \approx 13.6 \mathrm{~mL}$;量筒规格需略大于量取溶液的体积,选$25 \mathrm{~mL}$量筒。
(6)若用量筒量取浓硫酸时仰视刻度线,则量取的浓硫酸体积偏大,所配溶液浓度偏大。
(解析人:陈褚云)
查看更多完整答案,请扫码查看


