2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
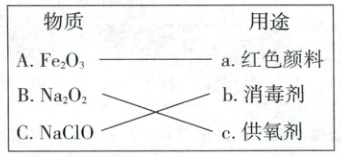
26. (3 分)将物质及其用途连线。


答案:
26.(3分,每空1分)
物质的性质与用途
【解析】氧化铁为红棕色固体,可用作红色颜料;过氧化钠能与二氧化碳或水反应产生氧气,可用作供氧剂;次氯酸钠具有强氧化性,可用作消毒剂。
26.(3分,每空1分)

物质的性质与用途
【解析】氧化铁为红棕色固体,可用作红色颜料;过氧化钠能与二氧化碳或水反应产生氧气,可用作供氧剂;次氯酸钠具有强氧化性,可用作消毒剂。
27. (4 分)化工厂用浓氨水检验氯气是否漏气,利用的反应如下:
8NH₃ + 3Cl₂ = 6NH₄Cl + N₂
(1)氯元素的化合价______(填“升高”或“降低”),作还原剂的物质是______。
(2)若每消耗 3 mol Cl₂,则生成 N₂的体积是______ L(标准状况),转移电子的物质的量是______ mol。
8NH₃ + 3Cl₂ = 6NH₄Cl + N₂
(1)氯元素的化合价______(填“升高”或“降低”),作还原剂的物质是______。
(2)若每消耗 3 mol Cl₂,则生成 N₂的体积是______ L(标准状况),转移电子的物质的量是______ mol。
答案:
27.(4分,每空1分)
(1)降低 NH₃
(2)22.4 6
氧化还原反应
【解析】
(1)反应中氯元素从0价降低至-1价,发生还原反应;氮元素的化合价从-3升高至0,发生氧化反应,故氨气作还原剂。
(2)反应中每消耗3个氯分子,转移6个电子,生成1个氮分子,所以每消耗3mol氯气,转移6mol电子,生成1mol氮气,即标准状况下22.4L氮气。
(1)降低 NH₃
(2)22.4 6
氧化还原反应
【解析】
(1)反应中氯元素从0价降低至-1价,发生还原反应;氮元素的化合价从-3升高至0,发生氧化反应,故氨气作还原剂。
(2)反应中每消耗3个氯分子,转移6个电子,生成1个氮分子,所以每消耗3mol氯气,转移6mol电子,生成1mol氮气,即标准状况下22.4L氮气。
28. (4 分)实验室用 Na₂CO₃固体配制 100 mL 1.0 mol/L Na₂CO₃溶液的操作过程示意图如图所示。

(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、______。
(2)操作 1 中玻璃棒的作用是______。
(3)所配制的 Na₂CO₃溶液中 c(Na⁺)是______ mol/L。
(4)下列情况中,会使所配溶液浓度偏低的是______(填序号)。
a. 配制溶液所用的容量瓶洗净后没有烘干
b. 操作 3 中烧杯洗涤液未转移到容量瓶中
c. 定容时俯视观察液面

(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、______。
(2)操作 1 中玻璃棒的作用是______。
(3)所配制的 Na₂CO₃溶液中 c(Na⁺)是______ mol/L。
(4)下列情况中,会使所配溶液浓度偏低的是______(填序号)。
a. 配制溶液所用的容量瓶洗净后没有烘干
b. 操作 3 中烧杯洗涤液未转移到容量瓶中
c. 定容时俯视观察液面
答案:
28.(4分,每空1分)
(1)100mL容量瓶
(2)搅拌,加速固体溶解
(3)2.0
(4)b
一定物质的量浓度溶液的配制
【解析】
(1)由图可知,配制100mL1.0mol/L碳酸钠溶液需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、100mL容量瓶。
(2)操作1中玻璃棒的作用是搅拌,加速碳酸钠固体的溶解。
(3)c(Na⁺)=2c(Na₂CO₃)=2.0mol/L。
(4)容量瓶洗净后没有烘干,对所配溶液浓度无影响,a不符合题意;操作3中洗涤液未转移到容量瓶中,则溶质减少,所配溶液浓度偏低,b符合题意;定容时俯视观察液面,导致加水体积偏少,浓度偏高,c不符合题意;故选b。
(1)100mL容量瓶
(2)搅拌,加速固体溶解
(3)2.0
(4)b
一定物质的量浓度溶液的配制
【解析】
(1)由图可知,配制100mL1.0mol/L碳酸钠溶液需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、100mL容量瓶。
(2)操作1中玻璃棒的作用是搅拌,加速碳酸钠固体的溶解。
(3)c(Na⁺)=2c(Na₂CO₃)=2.0mol/L。
(4)容量瓶洗净后没有烘干,对所配溶液浓度无影响,a不符合题意;操作3中洗涤液未转移到容量瓶中,则溶质减少,所配溶液浓度偏低,b符合题意;定容时俯视观察液面,导致加水体积偏少,浓度偏高,c不符合题意;故选b。
29. (6 分)某小组探究 Na₂CO₃和 NaHCO₃的性质。
(1)探究溶解性。在两支试管中,分别加入约 1 g Na₂CO₃和 NaHCO₃固体,分别加入 5 mL 水,充分振荡后,一支试管中固体有剩余,剩余的固体是______。
(2)探究稳定性。用如图所示装置进行实验(部分夹持装置已略去)。
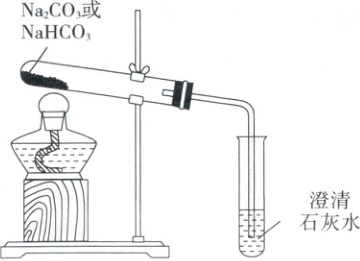
①能够证明 Na₂CO₃的热稳定性强于 NaHCO₃的证据是_。
②NaHCO₃受热分解的化学方程式是_。
(3)探究与酸的反应。

(4)该小组在探究 Na₂CO₃和 NaHCO₃的性质时,运用的化学思想方法有______(填序号)。
a. 比较
b. 定性与定量相结合
(1)探究溶解性。在两支试管中,分别加入约 1 g Na₂CO₃和 NaHCO₃固体,分别加入 5 mL 水,充分振荡后,一支试管中固体有剩余,剩余的固体是______。
(2)探究稳定性。用如图所示装置进行实验(部分夹持装置已略去)。

①能够证明 Na₂CO₃的热稳定性强于 NaHCO₃的证据是_。
②NaHCO₃受热分解的化学方程式是_。
(3)探究与酸的反应。

(4)该小组在探究 Na₂CO₃和 NaHCO₃的性质时,运用的化学思想方法有______(填序号)。
a. 比较
b. 定性与定量相结合
答案:
29.(6分,每空1分)
(1)NaHCO₃
(2)①加热NaHCO₃一段时间后,澄清石灰水变浑浊;加热Na₂CO₃一段时间后,澄清石灰水未见浑浊$ ②2NaHCO₃ \xlongequal{\triangle} Na₂CO₃+CO₂↑+H₂O$
(3)①CO₃²⁻+H⁺=HCO₃⁻ ②HCO₃⁻+H⁺=CO₂↑+H₂O
(4)ab
探究碳酸钠和碳酸氢钠的性质
【解析】
(1)碳酸钠的溶解度大于碳酸氢钠,所以等质量的碳酸钠和碳酸氢钠固体溶于等质量的水中,一支试管中有固体剩余,则该固体为碳酸氢钠。
(2)①碳酸钠受热后澄清石灰水不变浑浊,而碳酸氢钠受热后澄清石灰水变浑浊,说明碳酸钠的热稳定性强于碳酸氢钠。②碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,结合原子守恒即可得到化学方程式。
(3)向碳酸钠溶液中滴入稀盐酸,起始无气泡,说明碳酸钠与盐酸反应生成碳酸氢钠和氯化钠;当碳酸钠全部转化为碳酸氢钠,然后再加入稀盐酸,碳酸氢钠与盐酸反应,生成氯化钠、二氧化碳和水,即有气泡产生。
(4)结合上述研究过程可知,运用了比较、定量与定性相结合的思想方法。
(1)NaHCO₃
(2)①加热NaHCO₃一段时间后,澄清石灰水变浑浊;加热Na₂CO₃一段时间后,澄清石灰水未见浑浊$ ②2NaHCO₃ \xlongequal{\triangle} Na₂CO₃+CO₂↑+H₂O$
(3)①CO₃²⁻+H⁺=HCO₃⁻ ②HCO₃⁻+H⁺=CO₂↑+H₂O
(4)ab
探究碳酸钠和碳酸氢钠的性质
【解析】
(1)碳酸钠的溶解度大于碳酸氢钠,所以等质量的碳酸钠和碳酸氢钠固体溶于等质量的水中,一支试管中有固体剩余,则该固体为碳酸氢钠。
(2)①碳酸钠受热后澄清石灰水不变浑浊,而碳酸氢钠受热后澄清石灰水变浑浊,说明碳酸钠的热稳定性强于碳酸氢钠。②碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,结合原子守恒即可得到化学方程式。
(3)向碳酸钠溶液中滴入稀盐酸,起始无气泡,说明碳酸钠与盐酸反应生成碳酸氢钠和氯化钠;当碳酸钠全部转化为碳酸氢钠,然后再加入稀盐酸,碳酸氢钠与盐酸反应,生成氯化钠、二氧化碳和水,即有气泡产生。
(4)结合上述研究过程可知,运用了比较、定量与定性相结合的思想方法。
查看更多完整答案,请扫码查看


