2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10. 实验室中下列物质的转化不能通过一步反应实现的是( )
A.$ CaCO_3 \to CaO $
B.$ Al_2O_3 \to Al(OH)_3 $
C.$ Fe \to FeCl_2 $
D.$ NaHCO_3 \to NaCl $
A.$ CaCO_3 \to CaO $
B.$ Al_2O_3 \to Al(OH)_3 $
C.$ Fe \to FeCl_2 $
D.$ NaHCO_3 \to NaCl $
答案:
10.B 物质的转化 CaCO₃高温CaO + CO₂↑,A不符合题意;Al₂O₃不能通过一步反应生成Al(OH)₃,B符合题意;Fe + 2HCl = FeCl₂ + H₂↑或Fe + 2FeCl₃ = 3FeCl₂,C不符合题意;NaHCO₃ + HCl = NaCl + H₂O + CO₂↑,D不符合题意。
11. 某同学配制 240 mL 0.200 mol/L KCl 溶液,下列描述正确的是( )
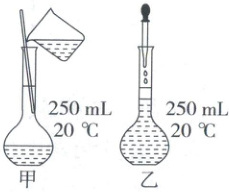
A.应选用 250 mL 规格的容量瓶
B.图甲为将烧杯中热的溶液转移至容量瓶
C.图乙是定容操作,胶头滴管应伸入容量瓶内
D.定容时俯视刻线,所配制溶液浓度偏低

A.应选用 250 mL 规格的容量瓶
B.图甲为将烧杯中热的溶液转移至容量瓶
C.图乙是定容操作,胶头滴管应伸入容量瓶内
D.定容时俯视刻线,所配制溶液浓度偏低
答案:
11.A 一定物质的量浓度溶液的配制 应选用250mL规格的容量瓶,A正确;溶液应冷却至室温后再转移至容量瓶中,B错误;定容时,胶头滴管应垂直悬空在容量瓶上方滴加蒸馏水,C错误;易错点 定容时俯视刻线,会造成溶液体积偏小,所配制的溶液浓度偏高,D错误。
12. 如图所示是碳元素的价类二维图,相关推断不合理的是( )
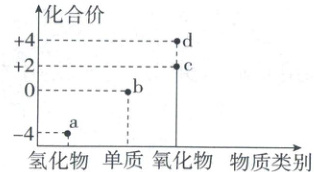
A.a 是一种清洁能源
B.c、d 都能与 NaOH 溶液反应
C.b 形成的两种不同单质互为同素异形体
D.b 转化为 d 需加氧化剂

A.a 是一种清洁能源
B.c、d 都能与 NaOH 溶液反应
C.b 形成的两种不同单质互为同素异形体
D.b 转化为 d 需加氧化剂
答案:
12.B 碳的价类二维图 根据化合价和物质类别可知,a为CH₄,b为C,c为CO,d为CO₂。CH₄完全燃烧生成CO₂和H₂O,无污染性气体生成,是清洁能源,A正确;CO不与NaOH溶液反应,B错误;同种元素形成的不同单质互为同素异形体,C正确;C转化为CO₂,碳元素化合价升高,被氧化,需要加入氧化剂,D正确。
13. 短周期主族元素 A、B、X、Y 核电荷数依次增大,A 与 X 同主族,X 的最外层电子数是内层电子总数的一半,B 的原子半径在短周期主族元素中最大。下列说法正确的是( )
A.离子半径:B > A
B.简单气态氢化物的稳定性:X > A
C.B 在空气中燃烧生成离子个数比为 1 : 1 的离子化合物
D.最高价氧化物对应水化物的酸性:X < Y
A.离子半径:B > A
B.简单气态氢化物的稳定性:X > A
C.B 在空气中燃烧生成离子个数比为 1 : 1 的离子化合物
D.最高价氧化物对应水化物的酸性:X < Y
答案:
13.D 元素周期表与元素周期律
【元素辨析】四种元素中,B的原子半径在短周期主族元素中最大,B是Na;X的最外层电子数是内层电子总数的一半,可以是Li或P,但X的核电荷数比Na的大,故X是P;A与X同主族,且核电荷数比X的小,A是N;Y可以是S或者Cl。
当核外电子数相同时,核电荷数越小,离子半径越大,离子半径:Na⁺ < N³⁻,A错误;元素非金属性越强,对应简单气态氢化物的稳定性越强,稳定性:PH₃ < NH₃,B错误;Na在空气中燃烧生成Na₂O₂,离子个数之比为2:1或1:2,C错误;易错点 元素非金属性越强,对应最高价含氧酸的酸性越强,酸性:H₃PO₄ < H₂SO₄,H₃PO₄ < HClO₄,D正确。
归纳总结
粒子半径大小比较的一般思维流程:
(1)①同周期原子半径(稀有气体元素原子除外)或同性离子半径从左到右减小;②同主族原子半径或离子半径从上到下均增大。
(2)同元素粒子:核外电子数越多,半径越大。
(3)同电子数粒子:核电荷数越大,半径越小。
(4)核电荷、电子层数、电子数均不同的粒子:可用参照法。
【元素辨析】四种元素中,B的原子半径在短周期主族元素中最大,B是Na;X的最外层电子数是内层电子总数的一半,可以是Li或P,但X的核电荷数比Na的大,故X是P;A与X同主族,且核电荷数比X的小,A是N;Y可以是S或者Cl。
当核外电子数相同时,核电荷数越小,离子半径越大,离子半径:Na⁺ < N³⁻,A错误;元素非金属性越强,对应简单气态氢化物的稳定性越强,稳定性:PH₃ < NH₃,B错误;Na在空气中燃烧生成Na₂O₂,离子个数之比为2:1或1:2,C错误;易错点 元素非金属性越强,对应最高价含氧酸的酸性越强,酸性:H₃PO₄ < H₂SO₄,H₃PO₄ < HClO₄,D正确。
归纳总结
粒子半径大小比较的一般思维流程:
(1)①同周期原子半径(稀有气体元素原子除外)或同性离子半径从左到右减小;②同主族原子半径或离子半径从上到下均增大。
(2)同元素粒子:核外电子数越多,半径越大。
(3)同电子数粒子:核电荷数越大,半径越小。
(4)核电荷、电子层数、电子数均不同的粒子:可用参照法。
14. 市售“84”消毒液显碱性,其有效成分是 NaClO。下列分析错误的是( )
A.制备“84”消毒液的离子方程式:$ Cl_2 + 2OH^- = Cl^- + ClO^- + H_2O $
B.加入 AgNO₃ 溶液有沉淀生成,证明“84”消毒液中含有 Cl⁻
C.消毒液作用于物体表面时适当放置一段时间效果更好
D.用次氯酸盐代替 Cl₂ 作消毒剂,存储更方便、使用更安全
A.制备“84”消毒液的离子方程式:$ Cl_2 + 2OH^- = Cl^- + ClO^- + H_2O $
B.加入 AgNO₃ 溶液有沉淀生成,证明“84”消毒液中含有 Cl⁻
C.消毒液作用于物体表面时适当放置一段时间效果更好
D.用次氯酸盐代替 Cl₂ 作消毒剂,存储更方便、使用更安全
答案:
14.B “84”消毒液 用Cl₂与NaOH溶液可制备“84”消毒液,A正确;加入AgNO₃溶液有沉淀生成,沉淀也可能为AgCO₃等,故不能证明“84”消毒液中含有Cl⁻,B错误;“84”消毒液放置一段时间,发生反应:2ClO⁻ + H₂O + CO₂ = CO₃²⁻ + 2HClO,消毒效果更好,C正确;次氯酸盐比Cl₂更易存储,使用更安全,D正确。
15. 为达到实验目的,下列方案设计恰当的是( )
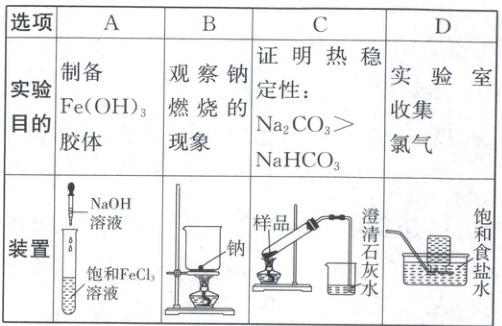

答案:
15.D 实验方案的设计与评价 向沸水中滴入饱和FeCl₃溶液,继续加热至液体变为红褐色,停止加热,得到Fe(OH)₃胶体,A错误;钠应放在坩埚中加热,B错误;加热固体时,试管口需略向下倾斜,C错误;Cl₂难溶于饱和食盐水,可以用排饱和食盐水的方法收集Cl₂,D正确。
16. 下列实验现象与操作相对应的是( )
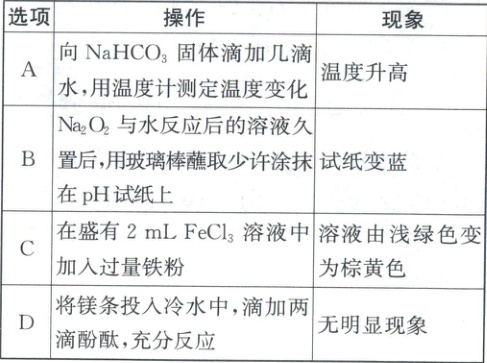

答案:
16.B 实验方案的设计与评价 NaHCO₃溶于水吸热,温度计示数降低,A错误;2Na₂O₂ + 2H₂O = 4NaOH + O₂↑,反应后久置,溶液显碱性,使pH试纸变蓝,B正确;Fe + 2FeCl₃ = 3FeCl₂,溶液由棕黄色变为浅绿色,C错误;镁条在冷水中反应很缓慢,会有少量气泡产生,D错误。
17. 下列离子在溶液中一定能大量共存的是( )
A.$ SO_4^{2-} $、$ Mg^{2+} $、$ NO_3^- $、$ Na^+ $
B.$ H^+ $、$ Cl^- $、$ OH^- $、$ K^+ $
C.$ Ca^{2+} $、$ CO_3^{2-} $、$ Cl^- $、$ I^- $
D.$ Fe^{2+} $、$ MnO_4^- $、$ H^+ $、$ SO_4^{2-} $
A.$ SO_4^{2-} $、$ Mg^{2+} $、$ NO_3^- $、$ Na^+ $
B.$ H^+ $、$ Cl^- $、$ OH^- $、$ K^+ $
C.$ Ca^{2+} $、$ CO_3^{2-} $、$ Cl^- $、$ I^- $
D.$ Fe^{2+} $、$ MnO_4^- $、$ H^+ $、$ SO_4^{2-} $
答案:
17.A 离子共存 能大量共存的离子之间不发生化学反应。SO₄²⁻、Mg²⁺、NO₃⁻、Na⁺之间不反应,A正确;H⁺与OH⁻能反应:H⁺ + OH⁻ = H₂O,B错误;Ca²⁺与CO₃²⁻能反应:Ca²⁺ + CO₃²⁻ = CaCO₃↓,C错误;Fe²⁺、H⁺、MnO₄⁻能反应:5Fe²⁺ + 8H⁺ + MnO₄⁻ = Mn²⁺ + 5Fe³⁺ + 4H₂O,D错误。
18. 某小组测定 NaHCO₃ 中杂质 Na₂CO₃ 的质量分数,设计实验:取固体混合物 m g,与足量稀硫酸充分反应,逸出的气体经干燥后用碱石灰吸收,质量增加 n g。下列方案评价不合理的是( )
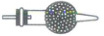
A.若换用盐酸溶解固体则不易达到实验目的
B.气体用碱石灰吸收前可经浓硫酸干燥
C.碱石灰盛装在如图仪器中
D.该方案中只测得 m 和 n 无法计算出 Na₂CO₃ 的质量

A.若换用盐酸溶解固体则不易达到实验目的
B.气体用碱石灰吸收前可经浓硫酸干燥
C.碱石灰盛装在如图仪器中
D.该方案中只测得 m 和 n 无法计算出 Na₂CO₃ 的质量
答案:
18.D Na₂CO₃质量分数的测定 用盐酸溶解固体,会使CO₂中混有HCl,HCl也可被碱石灰吸收,从而无法确定CO₂的质量,A正确;浓硫酸可以作干燥剂,吸收CO₂中的H₂O,B正确;碱石灰固体可以盛装在球形干燥管或者U形干燥管中,C正确;该方案可以计算出Na₂CO₃的质量,设NaHCO₃的物质的量为xmol,Na₂CO₃的物质的量为ymol,结合2NaHCO₃ + H₂SO₄ = Na₂SO₄ + 2H₂O + 2CO₂↑和Na₂CO₃ + H₂SO₄ = Na₂SO₄ + H₂O + CO₂↑可列式:(84x + 106y)g = mg和44(x + y)g = ng,解方程组即可求得Na₂CO₃的物质的量,从而计算出其质量,D错误。
查看更多完整答案,请扫码查看


