2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16.(14 分)K₂FeO₄ 为紫色固体,易溶于水,微溶于 KOH 溶液,不溶于乙醇;具有强氧化性,在 0~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 O₂。
(1)高铁酸钾(K₂FeO₄,M = 198 g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K₂FeO₄)进行水处理时,发生反应的化学方程式为 4K₂FeO₄ + 10H₂O = 4Fe(OH)₃(胶体) + 8KOH + 3O₂↑。
①K₂FeO₄ 属于______(填“酸”“碱”或“盐”)。
②现取 49.5 g 某高铁酸钾样品完全发生上述反应,生成标准状况下 3.36 L O₂,则反应中转移了______ mol e⁻,该高铁酸钾样品的纯度为______(用质量分数表示)。
③高铁酸钾可用于消毒的原因是______。
K₂FeO₄ 的制备常用两种方法:
Ⅰ. 湿法制备 K₂FeO₄(夹持装置略)

(2)下列试剂中,装置 B 中 X 溶液可以选用______(填字母)。
A. 饱和食盐水
B. 浓盐酸
C. 氢氧化钠溶液
D. 饱和 NaHCO₃ 溶液
(3)C 中 Cl₂ 与 Fe(OH)₃ 及 KOH 发生反应的化学方程式是______。
Ⅱ. 干法制备高铁酸钾分两步进行。
(4)第一步反应为 2FeSO₄ + 6Na₂O₂ = 2Na₂FeO₄ + 2Na₂SO₄ + 2Na₂O + O₂↑
第二步反应为 Na₂FeO₄ + 2KCl = K₂FeO₄↓ + 2NaCl
其中第一步反应中的还原剂是______。
(1)高铁酸钾(K₂FeO₄,M = 198 g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K₂FeO₄)进行水处理时,发生反应的化学方程式为 4K₂FeO₄ + 10H₂O = 4Fe(OH)₃(胶体) + 8KOH + 3O₂↑。
①K₂FeO₄ 属于______(填“酸”“碱”或“盐”)。
②现取 49.5 g 某高铁酸钾样品完全发生上述反应,生成标准状况下 3.36 L O₂,则反应中转移了______ mol e⁻,该高铁酸钾样品的纯度为______(用质量分数表示)。
③高铁酸钾可用于消毒的原因是______。
K₂FeO₄ 的制备常用两种方法:
Ⅰ. 湿法制备 K₂FeO₄(夹持装置略)

(2)下列试剂中,装置 B 中 X 溶液可以选用______(填字母)。
A. 饱和食盐水
B. 浓盐酸
C. 氢氧化钠溶液
D. 饱和 NaHCO₃ 溶液
(3)C 中 Cl₂ 与 Fe(OH)₃ 及 KOH 发生反应的化学方程式是______。
Ⅱ. 干法制备高铁酸钾分两步进行。
(4)第一步反应为 2FeSO₄ + 6Na₂O₂ = 2Na₂FeO₄ + 2Na₂SO₄ + 2Na₂O + O₂↑
第二步反应为 Na₂FeO₄ + 2KCl = K₂FeO₄↓ + 2NaCl
其中第一步反应中的还原剂是______。
答案:
16.(14分,每空2分)
(1)①盐 ②0.6 80% ③K₂FeO₄有强氧化性
(2)A
(3)3Cl₂ + 2Fe(OH)₃ + 10KOH 冰水浴2K₂FeO₄ + 6KCl + 8H₂O
(4)FeSO₄、Na₂O₂
K₂FeO₄的性质和制备
【实验剖析】

【解析】
(1)②标准状况下3.36L O₂的物质的量为0.15mol,根据反应的化学方程式可知生成3mol O₂时转移12mol电子,生成0.15mol O₂转移0.6mol电子。生成0.15mol O₂,则说明有0.2mol K₂FeO₄参与反应,K₂FeO₄的质量为39.6g,纯度为39.6g / 49.5g × 100% = 80%。③高铁酸钾具有强氧化性,可用于消毒。
(2)装置B的作用为除去氯气中的HCl,X溶液可选用饱和食盐水。
(3)C中Cl₂、Fe(OH)₃、KOH反应生成K₂FeO₄、KCl和水,化学方程式为3Cl₂ + 2Fe(OH)₃ + 10KOH 冰水浴2K₂FeO₄ + 6KCl + 8H₂O。
(4)第一步反应中FeSO₄失电子转化为高铁酸钠,同时Na₂O₂中部分O失电子转化为O₂,因此还原剂为FeSO₄和Na₂O₂。
16.(14分,每空2分)
(1)①盐 ②0.6 80% ③K₂FeO₄有强氧化性
(2)A
(3)3Cl₂ + 2Fe(OH)₃ + 10KOH 冰水浴2K₂FeO₄ + 6KCl + 8H₂O
(4)FeSO₄、Na₂O₂
K₂FeO₄的性质和制备
【实验剖析】

【解析】
(1)②标准状况下3.36L O₂的物质的量为0.15mol,根据反应的化学方程式可知生成3mol O₂时转移12mol电子,生成0.15mol O₂转移0.6mol电子。生成0.15mol O₂,则说明有0.2mol K₂FeO₄参与反应,K₂FeO₄的质量为39.6g,纯度为39.6g / 49.5g × 100% = 80%。③高铁酸钾具有强氧化性,可用于消毒。
(2)装置B的作用为除去氯气中的HCl,X溶液可选用饱和食盐水。
(3)C中Cl₂、Fe(OH)₃、KOH反应生成K₂FeO₄、KCl和水,化学方程式为3Cl₂ + 2Fe(OH)₃ + 10KOH 冰水浴2K₂FeO₄ + 6KCl + 8H₂O。
(4)第一步反应中FeSO₄失电子转化为高铁酸钠,同时Na₂O₂中部分O失电子转化为O₂,因此还原剂为FeSO₄和Na₂O₂。
17.(17 分)某粗盐溶液中除泥沙外,还含有 Ca²⁺、Mg²⁺、SO₄²⁻ 等杂质离子,粗盐提纯后可以通过侯氏制碱法(其反应原理为 NaCl + NH₃ + CO₂ + H₂O = NaHCO₃↓ + NH₄Cl)和电解饱和食盐水制取多种重要工业产品。如图是有关工艺流程,A、B、C、D、E、F 为中学化学常见物质。
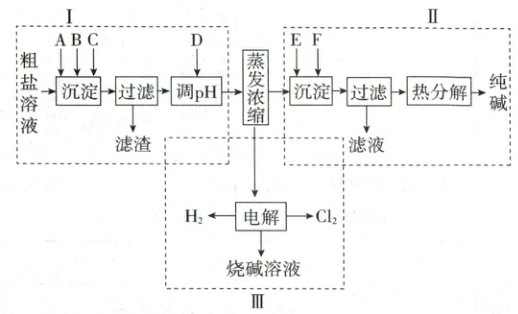
回答下列问题:
(1)环节Ⅰ中 A、B、C 依次应加入的物质为 NaOH、______、______,加入 D 发生反应的离子方程式为______、______。
(2)环节Ⅱ中为了产生更多沉淀 NaHCO₃,应先通入过量的气体 E 为______,再通入过量的 F。析出 NaHCO₃ 晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是______,热分解时需用到的仪器为______(填符号)。
A. 表面皿
B. 蒸发皿
C. 培养皿
D. 坩埚
(3)环节Ⅲ电解饱和食盐水的离子方程式为______。
(4)FeCO₃ 与砂糖混用可以作补血剂,工业上用 Na₂CO₃ 溶液和 FeSO₄ 溶液发生复分解反应制备 FeCO₃ [已知溶液 pH 大于 8.8 时,Fe²⁺ 转化为 Fe(OH)₂ 沉淀,实验中所用 Na₂CO₃ 溶液的 pH = 10]。
①在烧杯中混合上述溶液制备 FeCO₃ 沉淀时的具体操作作为______。
a. 将 Na₂CO₃ 溶液缓慢加入到盛有 FeSO₄ 溶液的反应容器中
b. 将 FeSO₄ 溶液缓慢加入到盛有 Na₂CO₃ 溶液的反应容器中
②将 FeSO₄ 溶液缓慢加入到盛有 NaHCO₃ 溶液的烧杯中也能得到 FeCO₃ 沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为______。

回答下列问题:
(1)环节Ⅰ中 A、B、C 依次应加入的物质为 NaOH、______、______,加入 D 发生反应的离子方程式为______、______。
(2)环节Ⅱ中为了产生更多沉淀 NaHCO₃,应先通入过量的气体 E 为______,再通入过量的 F。析出 NaHCO₃ 晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是______,热分解时需用到的仪器为______(填符号)。
A. 表面皿
B. 蒸发皿
C. 培养皿
D. 坩埚
(3)环节Ⅲ电解饱和食盐水的离子方程式为______。
(4)FeCO₃ 与砂糖混用可以作补血剂,工业上用 Na₂CO₃ 溶液和 FeSO₄ 溶液发生复分解反应制备 FeCO₃ [已知溶液 pH 大于 8.8 时,Fe²⁺ 转化为 Fe(OH)₂ 沉淀,实验中所用 Na₂CO₃ 溶液的 pH = 10]。
①在烧杯中混合上述溶液制备 FeCO₃ 沉淀时的具体操作作为______。
a. 将 Na₂CO₃ 溶液缓慢加入到盛有 FeSO₄ 溶液的反应容器中
b. 将 FeSO₄ 溶液缓慢加入到盛有 Na₂CO₃ 溶液的反应容器中
②将 FeSO₄ 溶液缓慢加入到盛有 NaHCO₃ 溶液的烧杯中也能得到 FeCO₃ 沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为______。
答案:
17.(17分,除标注外每空2分)
(1)BaCl₂ (1分) Na₂CO₃ (1分)
H⁺ + OH⁻ = H₂O CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O
(2)NH₃ (1分) 取少量晶体于试管中,加水溶解,加入过量稀硝酸,再加入适量硝酸银溶液,若有白色沉淀产生,则晶体中含有氯离子,反之则无 D
(3)2Cl⁻ + 2H₂O 通电Cl₂↑ + 2OH⁻ + H₂↑
(4)①a ②Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O
粗盐提纯、侯氏制碱法、电解饱和食盐水
【流程分析】

【解析】
(1)易错点除杂过程中Na₂CO₃需在BaCl₂之后加入,故环节Ⅰ中A、B、C依次加入的物质为NaOH、BaCl₂、Na₂CO₃,过滤后加入稀盐酸调节pH以除去过量的Na₂CO₃和NaOH,反应的离子方程式为H⁺ + OH⁻ = H₂O、CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O。
(2)环节Ⅱ为侯氏制碱法。由于NH₃在食盐水中溶解度较大,而CO₂在食盐水中溶解度很小,CO₂易溶于NH₃的饱和食盐水,故应先通入过量的气体E为NH₃,再通入过量的F为CO₂;析出NaHCO₃晶体中可能含有少量Cl⁻杂质,检验该晶体中是否含有Cl⁻杂质的操作方法是取少量晶体于试管中,加水溶解,加入过量稀硝酸,再加入适量硝酸银溶液,若有白色沉淀产生,则晶体中含有Cl⁻,反之则无。热分解时需用到的仪器为坩埚,故选D。
(3)环节Ⅲ电解饱和食盐水的化学方程式为2NaCl + 2H₂O 通电2NaOH + H₂↑ + Cl₂↑,其离子方程式为2Cl⁻ + 2H₂O 通电2OH⁻ + H₂↑ + Cl₂↑。
(4)①在烧杯中制备FeCO₃沉淀时,由于碳酸钠溶液的碱性较强,为避免生成氢氧化亚铁沉淀,应选用的加料方式为将Na₂CO₃溶液缓慢加入盛有FeSO₄溶液的反应容器中,答案为a。②将FeSO₄溶液缓慢加入盛有NaHCO₃溶液的烧杯中也能得到FeCO₃沉淀,同时在实验中观察到有无色无味的气体产生,根据元素守恒,该气体为CO₂,离子方程式为Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O。
易错警示:某粗盐溶液中除泥沙外,还含有Ca²⁺、Mg²⁺、SO₄²⁻等杂质离子,为除去杂质需加入Na₂CO₃、NaOH、BaCl₂溶液。注意试剂的加入顺序,Na₂CO₃需在BaCl₂之后,以除去Ca²⁺和过量的Ba²⁺,过滤后再加入稀盐酸调节pH以除去过量的Na₂CO₃和NaOH,然后蒸发浓缩制得精盐。
17.(17分,除标注外每空2分)
(1)BaCl₂ (1分) Na₂CO₃ (1分)
H⁺ + OH⁻ = H₂O CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O
(2)NH₃ (1分) 取少量晶体于试管中,加水溶解,加入过量稀硝酸,再加入适量硝酸银溶液,若有白色沉淀产生,则晶体中含有氯离子,反之则无 D
(3)2Cl⁻ + 2H₂O 通电Cl₂↑ + 2OH⁻ + H₂↑
(4)①a ②Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O
粗盐提纯、侯氏制碱法、电解饱和食盐水
【流程分析】

【解析】
(1)易错点除杂过程中Na₂CO₃需在BaCl₂之后加入,故环节Ⅰ中A、B、C依次加入的物质为NaOH、BaCl₂、Na₂CO₃,过滤后加入稀盐酸调节pH以除去过量的Na₂CO₃和NaOH,反应的离子方程式为H⁺ + OH⁻ = H₂O、CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O。
(2)环节Ⅱ为侯氏制碱法。由于NH₃在食盐水中溶解度较大,而CO₂在食盐水中溶解度很小,CO₂易溶于NH₃的饱和食盐水,故应先通入过量的气体E为NH₃,再通入过量的F为CO₂;析出NaHCO₃晶体中可能含有少量Cl⁻杂质,检验该晶体中是否含有Cl⁻杂质的操作方法是取少量晶体于试管中,加水溶解,加入过量稀硝酸,再加入适量硝酸银溶液,若有白色沉淀产生,则晶体中含有Cl⁻,反之则无。热分解时需用到的仪器为坩埚,故选D。
(3)环节Ⅲ电解饱和食盐水的化学方程式为2NaCl + 2H₂O 通电2NaOH + H₂↑ + Cl₂↑,其离子方程式为2Cl⁻ + 2H₂O 通电2OH⁻ + H₂↑ + Cl₂↑。
(4)①在烧杯中制备FeCO₃沉淀时,由于碳酸钠溶液的碱性较强,为避免生成氢氧化亚铁沉淀,应选用的加料方式为将Na₂CO₃溶液缓慢加入盛有FeSO₄溶液的反应容器中,答案为a。②将FeSO₄溶液缓慢加入盛有NaHCO₃溶液的烧杯中也能得到FeCO₃沉淀,同时在实验中观察到有无色无味的气体产生,根据元素守恒,该气体为CO₂,离子方程式为Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O。
易错警示:某粗盐溶液中除泥沙外,还含有Ca²⁺、Mg²⁺、SO₄²⁻等杂质离子,为除去杂质需加入Na₂CO₃、NaOH、BaCl₂溶液。注意试剂的加入顺序,Na₂CO₃需在BaCl₂之后,以除去Ca²⁺和过量的Ba²⁺,过滤后再加入稀盐酸调节pH以除去过量的Na₂CO₃和NaOH,然后蒸发浓缩制得精盐。
查看更多完整答案,请扫码查看


