2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. 亚氯酸钠(NaClO₂)是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
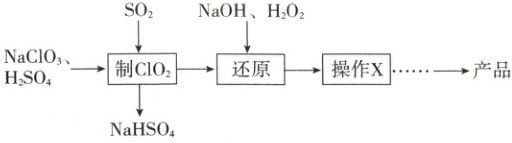
已知:“操作 X”为蒸发浓缩、冷却结晶。
下列说法正确的是( )
A.“制 ClO₂”中氧化剂与还原剂物质的量之比为 1:2
B.“还原”发生反应的离子方程式为 2ClO₂ + H₂O₂ = 2ClO₂⁻ + O₂↑ + 2H⁺
C.“操作 X”需要用到的仪器为坩埚、酒精灯、玻璃棒
D.NaClO₂作氧化剂时,转移电子的物质的量约为同质量 Cl₂的 1.57 倍

已知:“操作 X”为蒸发浓缩、冷却结晶。
下列说法正确的是( )
A.“制 ClO₂”中氧化剂与还原剂物质的量之比为 1:2
B.“还原”发生反应的离子方程式为 2ClO₂ + H₂O₂ = 2ClO₂⁻ + O₂↑ + 2H⁺
C.“操作 X”需要用到的仪器为坩埚、酒精灯、玻璃棒
D.NaClO₂作氧化剂时,转移电子的物质的量约为同质量 Cl₂的 1.57 倍
答案:
12.D 马蒂逊法制备亚氯酸钠 “制$ClO_2$”中氧化剂为$ClO_3^-$,氯元素化合价降低1价,还原剂为$SO_2$,硫元素化合价升高2价,氧化剂与还原剂物质的量之比为$2:1$,A错误;“还原”发生反应的离子方程式为$2ClO_2+H_2O_2+2OH^-=2ClO_2^-+O_2↑+2H_2O$,B错误;“操作 X”为蒸发浓缩、冷却结晶,不需要用到坩埚,C错误;$NaClO_2$作氧化剂时转化为$Cl^-$,化合价降低4价,$Cl_2$作氧化剂时化合价降低2价,同质量$NaClO_2$转移电子的物质的量约为$Cl_2$的$\frac{1}{35.5}×4÷\frac{1}{71}×2≈1.57$倍,D正确。
13. 一种利用 Fe²⁺和 Fe³⁺进行新型脱氮的过程如图所示。
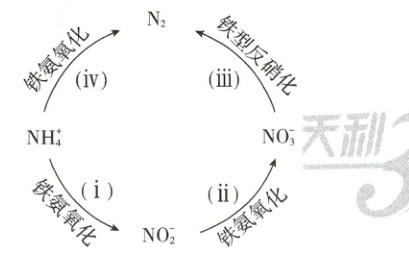
下列说法正确的是( )
A.铁氨氧化中,Fe²⁺转化为 Fe³⁺
B.将 1 mol NH₄⁺转化为 N₂,两个途径最终失去的电子数相同
C.反应ⅲ的离子方程式为 2NO₃⁻ + 10Fe²⁺ + 12H⁺ = N₂↑ + 10Fe³⁺ + 6H₂O
D.四步反应中,氮元素均被氧化

下列说法正确的是( )
A.铁氨氧化中,Fe²⁺转化为 Fe³⁺
B.将 1 mol NH₄⁺转化为 N₂,两个途径最终失去的电子数相同
C.反应ⅲ的离子方程式为 2NO₃⁻ + 10Fe²⁺ + 12H⁺ = N₂↑ + 10Fe³⁺ + 6H₂O
D.四步反应中,氮元素均被氧化
答案:
13.BC 一种新型脱氮流程分析 铁氨氧化中,N 元素化合价升高,故$Fe^{3+}$转化为$Fe^{2+}$,A错误;将$NH_4^+$转化为$N_2$,两个途径不同,但氮元素的始末价态相同,最终失去的电子数相同,B正确;反应ⅲ中$NO_3^-→N_2$,其反应的离子方程式为$2NO_3^-+10Fe^{2+}+12H^+=N_2↑+10Fe^{3+}+6H_2O$,C正确;四步反应中,步骤ⅲ中$NO_3^-→N_2$,氮元素被还原,D错误。
14. 某同学研究银的性质,进行如下实验:
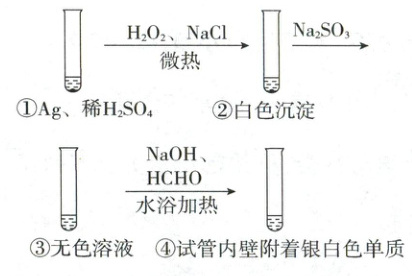
已知:③中无色溶液含有[Ag(SO₃)₂]³⁻。
下列说法错误的是( )
A.①→②发生反应 2Ag + H₂O₂ + 2Cl⁻ + 2H⁺ = 2AgCl + 2H₂O
B.H₂O₂实际消耗比理论用量多
C.③→④反应的离子方程式为 4[Ag(SO₃)₂]³⁻ + HCHO + 4OH⁻ = 4Ag↓ + CO₂↑ + 8SO₃²⁻ + 3H₂O
D.该实验中发生的反应均为氧化还原反应

已知:③中无色溶液含有[Ag(SO₃)₂]³⁻。
下列说法错误的是( )
A.①→②发生反应 2Ag + H₂O₂ + 2Cl⁻ + 2H⁺ = 2AgCl + 2H₂O
B.H₂O₂实际消耗比理论用量多
C.③→④反应的离子方程式为 4[Ag(SO₃)₂]³⁻ + HCHO + 4OH⁻ = 4Ag↓ + CO₂↑ + 8SO₃²⁻ + 3H₂O
D.该实验中发生的反应均为氧化还原反应
答案:
14.CD 银的性质探究实验
【实验剖析】
酸性条件下双氧水将单质银氧化,生成的$Ag^+$与$Cl^-$结合生成$AgCl$沉淀

$①→②$发生反应$2Ag+H_2O_2+2Cl^-+2H^+=2AgCl+2H_2O$,A 正确;$Ag^+$能催化$H_2O_2$分解,$H_2O_2$受热也易分解,$H_2O_2$实际消耗比理论用量多,B 正确;$③→④$为碱性环境,其反应的离子方程式为$4[Ag(SO_3)_2]^{3-}+HCHO+6OH^-=4Ag↓+CO_3^{2-}+8SO_3^{2-}+4H_2O$,C错误;反应$②→③$中无元素化合价变化,为非氧化还原反应,D错误。
14.CD 银的性质探究实验
【实验剖析】
酸性条件下双氧水将单质银氧化,生成的$Ag^+$与$Cl^-$结合生成$AgCl$沉淀

$①→②$发生反应$2Ag+H_2O_2+2Cl^-+2H^+=2AgCl+2H_2O$,A 正确;$Ag^+$能催化$H_2O_2$分解,$H_2O_2$受热也易分解,$H_2O_2$实际消耗比理论用量多,B 正确;$③→④$为碱性环境,其反应的离子方程式为$4[Ag(SO_3)_2]^{3-}+HCHO+6OH^-=4Ag↓+CO_3^{2-}+8SO_3^{2-}+4H_2O$,C错误;反应$②→③$中无元素化合价变化,为非氧化还原反应,D错误。
15. 工业上可用次氯酸盐将氨氮废水转化为 N₂实现绿色处理。实验室模拟如下:
取等量氨水分别和不同量的 NaClO 混合(混合溶液体积为 1 L),测得溶液中氨氮(氨、NH₂Cl)和总氮(氨氮和 NO₃⁻的总和)的去除率及 NH₂Cl 的浓度与 NaClO 的加入量关系如图所示。
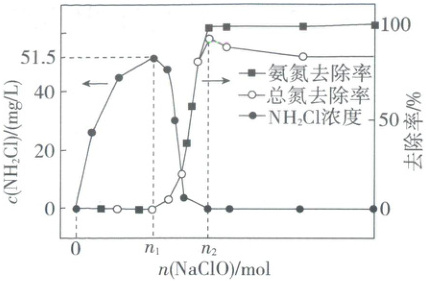
在此过程中发生的反应:
①NH₃ + ClO⁻ = NH₂Cl + OH⁻
②2NH₃ + 3ClO⁻ = N₂ + 3Cl⁻ + 3H₂O
③NH₃ + 4ClO⁻ + OH⁻ = NO₃⁻ + 4Cl⁻ + 2H₂O
已知:NH₂Cl 中氮元素为 -3 价。
下列说法正确的是( )
A.当 n(NaClO) = n₁ 时,反应①中转移电子的物质的量为 0.002 mol
B.当 n(NaClO) = 0.0012 mol 时,c(NH₂Cl) = 30.9 mg/L
C.n₂ = 0.0015
D.当 n(NaClO) > n₂ 时,c(Cl⁻) = 4c(NO₃⁻)
取等量氨水分别和不同量的 NaClO 混合(混合溶液体积为 1 L),测得溶液中氨氮(氨、NH₂Cl)和总氮(氨氮和 NO₃⁻的总和)的去除率及 NH₂Cl 的浓度与 NaClO 的加入量关系如图所示。

在此过程中发生的反应:
①NH₃ + ClO⁻ = NH₂Cl + OH⁻
②2NH₃ + 3ClO⁻ = N₂ + 3Cl⁻ + 3H₂O
③NH₃ + 4ClO⁻ + OH⁻ = NO₃⁻ + 4Cl⁻ + 2H₂O
已知:NH₂Cl 中氮元素为 -3 价。
下列说法正确的是( )
A.当 n(NaClO) = n₁ 时,反应①中转移电子的物质的量为 0.002 mol
B.当 n(NaClO) = 0.0012 mol 时,c(NH₂Cl) = 30.9 mg/L
C.n₂ = 0.0015
D.当 n(NaClO) > n₂ 时,c(Cl⁻) = 4c(NO₃⁻)
答案:
15.B 氨氮废水的绿色处理 当$n(NaClO)=n_1$时氨氮去除率和总氮去除率均为0,说明只发生反应①,由反应①的离子方程式$NH_3+ClO^-=NH_2Cl+OH^-$可知,反应①为非氧化还原反应,无电子转移,A 错误;根据$n_1$时$c(NH_2Cl)=51.5mg/L$可知,$n_1$时$n(NH_3)=n(NH_2Cl)=\frac{51.5×10^{-3}g/L×1L}{51.5g/mol}=0.001mol$,当$n(NaClO)=0.0012mol$时,同时发生反应①和②,设反应①中消耗$NH_3xmol$,反应②中消耗$NH_3ymol$,可列方程$x+y=0.001$、$x+1.5y=0.0012$,解得$x=0.0006$、$y=0.0004$,故反应①生成$NH_2Cl$的物质的量为$0.0006mol$,其浓度为$c(NH_2Cl)=\frac{0.0006mol×51.5g/mol×1000mg/g}{1L}=30.9mg/L$,B正确;$n_2$时,氨氮去除率为100%,总氮去除率低于100%,$c(NH_2Cl)=0mg/L$,说明部分氨发生反应③,又$2NH_2Cl+ClO^-+2OH^-=N_2↑+3Cl^-+3H_2O$,则$n_2>0.0015mol$,C错误;当$n(NaClO)>n_2$时,发生反应②和③,无具体数据,无法计算,D错误。
查看更多完整答案,请扫码查看


