2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
14. 为探究钠的部分性质,设计实验操作如图:
①向如图所示的试管中加入苯(已知苯不溶于水,密度为 0.86 g/cm³);
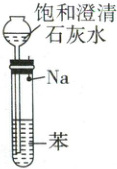
②拔出大头针,使 Na(密度为 0.97 g/cm³)落入苯中(钠与苯不反应);
③从长颈漏斗中加入饱和澄清石灰水(密度约为 1.6 g/cm³)。
对上述实验现象的说法错误的是( )
A.Na 在石灰水与苯的界面处反应,并上下跳动
B.Na 燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
①向如图所示的试管中加入苯(已知苯不溶于水,密度为 0.86 g/cm³);

②拔出大头针,使 Na(密度为 0.97 g/cm³)落入苯中(钠与苯不反应);
③从长颈漏斗中加入饱和澄清石灰水(密度约为 1.6 g/cm³)。
对上述实验现象的说法错误的是( )
A.Na 在石灰水与苯的界面处反应,并上下跳动
B.Na 燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
答案:
14. B钠的性质 由于ρ(苯) < ρ(Na) < ρ(澄清石灰水),所以金属Na在澄清石灰水与苯的界面处与溶液中的水反应产生H₂,氢气使Na受到的浮力增大,钠块上升,后又下落到界面处的石灰水溶液中进一步与水反应,钠块上下跳动直至消失,A正确;由于苯隔离空气,所以Na不会燃烧,B错误;由于Na与水反应放热,溶剂的量减少,且氢氧化钙溶解度随温度升高而降低,故澄清石灰水变浑浊,C正确;钠与水反应生成的氢气难溶于苯,所以苯层可观察到有气泡产生,D正确。
15. 向 200 mL c mol/L FeBr₂ 溶液中逐渐通入 Cl₂,其中 n(Fe²⁺)、n(Br⁻) 随通入 Cl₂ 物质的量 [n(Cl₂)] 的变化如图所示(已知:Cl₂ + 2Br⁻ = 2Cl⁻ + Br₂)。下列说法正确的是( )
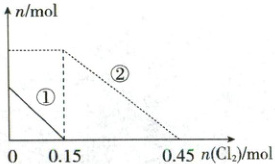
A.c = 0.30
B.由图可判断反应 2Br⁻ + 2Fe³⁺ = Br₂ + 2Fe²⁺ 可以发生
C.当溶液中 c(Fe³⁺) = c(Br⁻) 时,n(Cl₂) 可能在 0~0.15 之间
D.n(Cl₂) = 0.30 mol 时,总的离子方程式为 2Cl₂ + 2Fe²⁺ + 2Br⁻ = 2Fe³⁺ + Br₂ + 4Cl⁻

A.c = 0.30
B.由图可判断反应 2Br⁻ + 2Fe³⁺ = Br₂ + 2Fe²⁺ 可以发生
C.当溶液中 c(Fe³⁺) = c(Br⁻) 时,n(Cl₂) 可能在 0~0.15 之间
D.n(Cl₂) = 0.30 mol 时,总的离子方程式为 2Cl₂ + 2Fe²⁺ + 2Br⁻ = 2Fe³⁺ + Br₂ + 4Cl⁻
答案:
15. D离子反应、氧化还原反应、化学计算 还原性:Fe²⁺ > Br⁻,n(FeBr₂) = 0.2 L×c mol/L = 0.2c mol,通入0.15 mol Cl₂时,Fe²⁺恰好反应完全,n(Fe²⁺) = 2n(Cl₂) = 0.3 mol,即0.2c mol = 0.3 mol,c = 1.5,A错误;还原性:Fe²⁺ > Br⁻,根据氧化还原反应规律可知,反应2Br⁻ + 2Fe³⁺ = Br₂ + 2Fe²⁺不能发生,B错误;由A项分析可知,c = 1.5,起始时n(FeBr₂) = 0.3 mol,n(Fe²⁺) = 0.3 mol,c(Br⁻) = 0.6 mol,若溶液中c(Fe³⁺) = c(Br⁻),则Br⁻应部分发生反应,0.3 mol Fe²⁺反应时2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻,消耗n(Cl₂) = 0.15 mol,所以当溶液中c(Fe³⁺) = c(Br⁻)时,n(Cl₂) > 0.15 mol,C错误;n(Cl₂) = 0.30 mol时,0.3 mol Fe²⁺反应完全,Br⁻部分发生反应,根据电子守恒可得n(Fe²⁺) + n(Br⁻) = 2n(Cl₂),即0.3 mol + n(Br⁻) = 0.6 mol,n(Br⁻) = 0.3 mol,n(Fe²⁺) : n(Cl₂) : n(Br⁻) = 1:1:1,则反应为2Cl₂ + 2Fe²⁺ + 2Br⁻ = 2Fe³⁺ + Br₂ + 4Cl⁻,D正确。
归纳总结:当溶液中存在多种还原性微粒可以被某种氧化剂氧化时,一般来说,发生的反应有一定的先后顺序,通常是还原性强的微粒优先与氧化剂发生反应,如还原性:Fe²⁺ > Br⁻,当FeBr₂中逐渐通入氯气时,依次发生的反应为2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻、2Br⁻ + Cl₂ = Br₂ + 2Cl⁻。
归纳总结:当溶液中存在多种还原性微粒可以被某种氧化剂氧化时,一般来说,发生的反应有一定的先后顺序,通常是还原性强的微粒优先与氧化剂发生反应,如还原性:Fe²⁺ > Br⁻,当FeBr₂中逐渐通入氯气时,依次发生的反应为2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻、2Br⁻ + Cl₂ = Br₂ + 2Cl⁻。
16.(14 分)Ⅰ. 分类法有助于人们发现和预测物质的性质,在化学学习中,科学的分类方法几乎是无可替代的。
(1)按要求对以下物质进行分类:①黄铜;②Na₂CO₃·10H₂O;③NaOH 溶液;④熔融 NaCl;⑤酒精;⑥氨气;⑦HCl 气体。上述物质中能导电的是__________(填序号,下同);属于电解质的是__________;属于非电解质的是__________。
(2)写出物质②在水溶液中的电离方程式:________________________;干燥的 NaCl 不能导电的原因是________________________。
Ⅱ. 氧化还原反应是一类重要的化学反应。
(3)已知 R₂O₈ⁿ⁻ 在一定条件下可以把 Mn²⁺ 氧化为 MnO₄⁻,R₂O₈ⁿ⁻ 被还原为 RO₄²⁻,反应中氧化剂与还原剂的物质的量之比为 5∶2,则 n = __________,写出上述反应的离子方程式,并用单线桥法标出电子转移的方向和数目:________________________。若 19.2 g R₂O₈ⁿ⁻ 中含氧原子的个数为 0.8NA,则 R 的相对原子质量为__________。
(1)按要求对以下物质进行分类:①黄铜;②Na₂CO₃·10H₂O;③NaOH 溶液;④熔融 NaCl;⑤酒精;⑥氨气;⑦HCl 气体。上述物质中能导电的是__________(填序号,下同);属于电解质的是__________;属于非电解质的是__________。
(2)写出物质②在水溶液中的电离方程式:________________________;干燥的 NaCl 不能导电的原因是________________________。
Ⅱ. 氧化还原反应是一类重要的化学反应。
(3)已知 R₂O₈ⁿ⁻ 在一定条件下可以把 Mn²⁺ 氧化为 MnO₄⁻,R₂O₈ⁿ⁻ 被还原为 RO₄²⁻,反应中氧化剂与还原剂的物质的量之比为 5∶2,则 n = __________,写出上述反应的离子方程式,并用单线桥法标出电子转移的方向和数目:________________________。若 19.2 g R₂O₈ⁿ⁻ 中含氧原子的个数为 0.8NA,则 R 的相对原子质量为__________。
答案:
16. (14分)
(1)①③④ (2分) ②④⑦ (2分) ⑤⑥ (2分)
(2)Na₂CO₃ = 2Na⁺ + CO₃²⁻ (1分) 干燥的NaCl中Na⁺和Cl⁻不能自由移动 (合理即可,1分)
(3)2 (2分) 5R₂O₈²⁻ + 2Mn²⁺ + 8H₂O = 2MnO₄⁻ + 10RO₄²⁻ + 16H⁺ (2分) 32 (2分)
电解质与非电解质、电离方程式、氧化还原反应
【解析】
(1)电解质是指在水溶液中或熔融状态下能够导电的化合物,非电解质是指在水溶液中和熔融状态下都不导电的化合物。①黄铜能导电,既不是电解质也不是非电解质,②Na₂CO₃·10H₂O不能导电,属于电解质,③NaOH溶液能导电,既不是电解质也不是非电解质,④熔融NaCl能导电,属于电解质,⑤酒精不能导电,不能电离,属于非电解质,⑥氨气不能导电,不能电离,属于非电解质,⑦HCl气体不能导电,溶于水导电,属于电解质,上述物质中能导电的是①③④,属于电解质的是②④⑦,属于非电解质的是⑤⑥。
(2)Na₂CO₃在水溶液中电离产生Na⁺和CO₃²⁻;干燥的NaCl中Na⁺和Cl⁻不能自由移动,导致其不能导电。
(3)已知R₂O₈ⁿ⁻在一定条件下可以把Mn²⁺氧化为MnO₄⁻,电子转移:Mn²⁺~MnO₄⁻~5e⁻,R₂O₈ⁿ⁻被还原为RO₄²⁻,$R₂O₈ⁿ⁻~2RO₄²⁻~[\frac{16 - n}{2} - 6]×2e⁻ = (4 - n)e⁻,$该反应中,锰元素的化合价变化为+2→+7,失电子,化合价升高,锰离子作还原剂,氧元素的化合价不变,R元素得电子,化合价降低,R₂O₈ⁿ⁻作氧化剂,即R₂O₈ⁿ⁻与Mn²⁺的物质的量之比为5:2,根据各元素的原子守恒写出并配平,该反应方程式为8H₂O + 5R₂O₈ⁿ⁻ + 2Mn²⁺ = 2MnO₄⁻ + 10RO₄²⁻ + 16H⁺,再由电荷守恒得-5n + 2×2 = -1×2 + (-2×10) + 1×16,则n = 2;单线桥法表示电子转移时,电子转移总数为10e⁻;若19.2 g R₂O₈ⁿ⁻中含氧原子的个数为0.8N_A,得到$\frac{19.2 g}{(2×M_R + 8×16) g/mol}×8 = 0.8 mol,$所以R的相对原子质量为32。
(1)①③④ (2分) ②④⑦ (2分) ⑤⑥ (2分)
(2)Na₂CO₃ = 2Na⁺ + CO₃²⁻ (1分) 干燥的NaCl中Na⁺和Cl⁻不能自由移动 (合理即可,1分)
(3)2 (2分) 5R₂O₈²⁻ + 2Mn²⁺ + 8H₂O = 2MnO₄⁻ + 10RO₄²⁻ + 16H⁺ (2分) 32 (2分)
电解质与非电解质、电离方程式、氧化还原反应
【解析】
(1)电解质是指在水溶液中或熔融状态下能够导电的化合物,非电解质是指在水溶液中和熔融状态下都不导电的化合物。①黄铜能导电,既不是电解质也不是非电解质,②Na₂CO₃·10H₂O不能导电,属于电解质,③NaOH溶液能导电,既不是电解质也不是非电解质,④熔融NaCl能导电,属于电解质,⑤酒精不能导电,不能电离,属于非电解质,⑥氨气不能导电,不能电离,属于非电解质,⑦HCl气体不能导电,溶于水导电,属于电解质,上述物质中能导电的是①③④,属于电解质的是②④⑦,属于非电解质的是⑤⑥。
(2)Na₂CO₃在水溶液中电离产生Na⁺和CO₃²⁻;干燥的NaCl中Na⁺和Cl⁻不能自由移动,导致其不能导电。
(3)已知R₂O₈ⁿ⁻在一定条件下可以把Mn²⁺氧化为MnO₄⁻,电子转移:Mn²⁺~MnO₄⁻~5e⁻,R₂O₈ⁿ⁻被还原为RO₄²⁻,$R₂O₈ⁿ⁻~2RO₄²⁻~[\frac{16 - n}{2} - 6]×2e⁻ = (4 - n)e⁻,$该反应中,锰元素的化合价变化为+2→+7,失电子,化合价升高,锰离子作还原剂,氧元素的化合价不变,R元素得电子,化合价降低,R₂O₈ⁿ⁻作氧化剂,即R₂O₈ⁿ⁻与Mn²⁺的物质的量之比为5:2,根据各元素的原子守恒写出并配平,该反应方程式为8H₂O + 5R₂O₈ⁿ⁻ + 2Mn²⁺ = 2MnO₄⁻ + 10RO₄²⁻ + 16H⁺,再由电荷守恒得-5n + 2×2 = -1×2 + (-2×10) + 1×16,则n = 2;单线桥法表示电子转移时,电子转移总数为10e⁻;若19.2 g R₂O₈ⁿ⁻中含氧原子的个数为0.8N_A,得到$\frac{19.2 g}{(2×M_R + 8×16) g/mol}×8 = 0.8 mol,$所以R的相对原子质量为32。
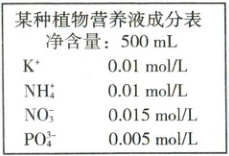
17.(13 分)农作物生产离不开肥料,其中对 N、P、K 三种元素的需求最大。如图为培养某植物需要配制的 500 mL 营养液。
(1)所用容量瓶在使用前应________________________。
(2)配制溶液时,正确的操作顺序是 C→______→______→______→A→E(填字母)。操作 A 为定容,具体的操作方法是________________________。
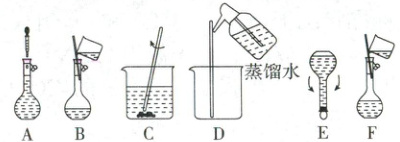
(3)在配制过程中,下列实验操作会使所配制溶液的浓度偏小的是__________(填字母)。
A. 配制溶液时,容量瓶用水洗净后未干燥
B. 洗涤时,未冲洗玻璃棒
C. 定容时仰视刻线
D. 定容后经摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)某同学在实验室中找到了 KCl、NH₄Cl、NaNO₃、Na₃PO₄ 四种物质用于配制该营养液,所取上述各物质(按上述顺序)的物质的量之比为______。若用实验室剩余的 0.5 mol/L 的 NH₄Cl 溶液代替固体 NH₄Cl,则需要 0.5 mol/L 的 NH₄Cl 溶液的体积为______mL。
(5)若要检验所配制营养液中的 K⁺,可进行的操作是________________________。
(1)所用容量瓶在使用前应________________________。
(2)配制溶液时,正确的操作顺序是 C→______→______→______→A→E(填字母)。操作 A 为定容,具体的操作方法是________________________。

(3)在配制过程中,下列实验操作会使所配制溶液的浓度偏小的是__________(填字母)。
A. 配制溶液时,容量瓶用水洗净后未干燥
B. 洗涤时,未冲洗玻璃棒
C. 定容时仰视刻线
D. 定容后经摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)某同学在实验室中找到了 KCl、NH₄Cl、NaNO₃、Na₃PO₄ 四种物质用于配制该营养液,所取上述各物质(按上述顺序)的物质的量之比为______。若用实验室剩余的 0.5 mol/L 的 NH₄Cl 溶液代替固体 NH₄Cl,则需要 0.5 mol/L 的 NH₄Cl 溶液的体积为______mL。
(5)若要检验所配制营养液中的 K⁺,可进行的操作是________________________。

答案:
17. (13分)
(1)检查容量瓶是否完好,瓶口处是否漏水 (合理即可,1分)
(2)B D F (全对得2分) 加蒸馏水至刻线1~2 cm时,用胶头滴管滴加蒸馏水至溶液的凹液面与刻线相切 (2分)
(3)B C D (2分)
(4)2:2:3:1 (2分) 10 (2分)
(5)将铂丝(或铁丝)在酒精灯外焰上灼烧至与原来的火焰颜色相同,再蘸取营养液在外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 (合理即可,2分)
一定物质的量浓度溶液的配制、离子检验、焰色试验
【解析】
(1)使用容量瓶前要检查它是否完好,是否漏水,防止在配制溶液过程中漏液。
(2)配制一定物质的量浓度溶液的步骤是计算、量取、稀释、冷却、移液、定容、摇匀、装瓶、贴标签,故正确的操作顺序为CBDFAE。
(3)配制溶液时,容量瓶用水洗净后,若未干燥即用来配制溶液,所配溶液浓度不变,A错误;未洗涤玻璃棒,导致溶质的物质的量偏小,配制的溶液浓度偏低,B正确;定容时,仰视刻线,导致溶剂的体积偏大,所以配制溶液的浓度偏低,C正确;摇匀后发现液面低于刻线再加水,导致溶剂的体积偏大,配制溶液的浓度偏低,D正确,故选BCD。
(4)营养液中c(K⁺) = 0.01 mol/L,则需要c(KCl) = 0.01 mol/L;c(NH₄⁺) = 0.01 mol/L,则需要c(NH₄Cl) = 0.01 mol/L;c(NO₃⁻) = 0.015 mol/L,则需要c(NaNO₃) = 0.015 mol/L;c(PO₄³⁻) = 0.005 mol/L,则需要c(Na₃PO₄) = 0.005 mol/L;同一溶液中,物质的浓度之比等于物质的量之比,所取上述各物质(按上述顺序)的物质的量之比为2:2:3:1;营养液中n(NH₄⁺) = 0.01 mol/L×0.5 L,则需要0.5 mol/L的NH₄Cl溶液的体积为0.01 mol/L×0.5 L÷0.5 mol/L = 0.01 L = 10 mL。
(1)检查容量瓶是否完好,瓶口处是否漏水 (合理即可,1分)
(2)B D F (全对得2分) 加蒸馏水至刻线1~2 cm时,用胶头滴管滴加蒸馏水至溶液的凹液面与刻线相切 (2分)
(3)B C D (2分)
(4)2:2:3:1 (2分) 10 (2分)
(5)将铂丝(或铁丝)在酒精灯外焰上灼烧至与原来的火焰颜色相同,再蘸取营养液在外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 (合理即可,2分)
一定物质的量浓度溶液的配制、离子检验、焰色试验
【解析】
(1)使用容量瓶前要检查它是否完好,是否漏水,防止在配制溶液过程中漏液。
(2)配制一定物质的量浓度溶液的步骤是计算、量取、稀释、冷却、移液、定容、摇匀、装瓶、贴标签,故正确的操作顺序为CBDFAE。
(3)配制溶液时,容量瓶用水洗净后,若未干燥即用来配制溶液,所配溶液浓度不变,A错误;未洗涤玻璃棒,导致溶质的物质的量偏小,配制的溶液浓度偏低,B正确;定容时,仰视刻线,导致溶剂的体积偏大,所以配制溶液的浓度偏低,C正确;摇匀后发现液面低于刻线再加水,导致溶剂的体积偏大,配制溶液的浓度偏低,D正确,故选BCD。
(4)营养液中c(K⁺) = 0.01 mol/L,则需要c(KCl) = 0.01 mol/L;c(NH₄⁺) = 0.01 mol/L,则需要c(NH₄Cl) = 0.01 mol/L;c(NO₃⁻) = 0.015 mol/L,则需要c(NaNO₃) = 0.015 mol/L;c(PO₄³⁻) = 0.005 mol/L,则需要c(Na₃PO₄) = 0.005 mol/L;同一溶液中,物质的浓度之比等于物质的量之比,所取上述各物质(按上述顺序)的物质的量之比为2:2:3:1;营养液中n(NH₄⁺) = 0.01 mol/L×0.5 L,则需要0.5 mol/L的NH₄Cl溶液的体积为0.01 mol/L×0.5 L÷0.5 mol/L = 0.01 L = 10 mL。
18.(14 分)联合制碱法(又称侯氏制碱法),因其提高了食盐的转化率,减少了对环境的污染,从而赢得了国际化工界的高度评价。联合制碱法的主要过程如图甲所示:
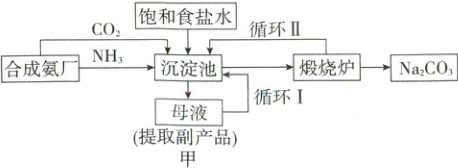
已知:沉淀池中的反应原理如下:
ⅰ. NH₃ + CO₂ + H₂O = NH₄HCO₃
ⅱ. NaCl + NH₄HCO₃ = NaHCO₃↓ + NH₄Cl
(1)“侯氏制碱法”中的“碱”为__________(填化学式);写出煅烧炉中反应的化学方程式:________________________。
(2)在饱和食盐水中先通入 NH₃,再通入 CO₂,这样操作的目的是________________________。
(3)从“母液”中可得到的副产品为__________,用途是__________(任写一种)。
(4)“循环Ⅱ”中参与循环的物质除水外还有__________。
(5)常温下,在 10 mL 0.1 mol/L Na₂CO₃ 溶液中逐滴加入 0.1 mol/L HCl 溶液 20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液 pH 变化的部分情况如图乙所示。回答下列问题:
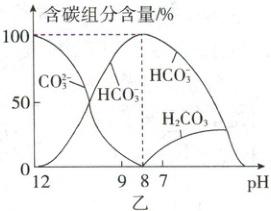
①在同一溶液中,三种含碳微粒 CO₃²⁻、HCO₃⁻、H₂CO₃__________(填“能”或“不能”)大量共存。
②将 0.84 g NaHCO₃ 和 1.06 g Na₂CO₃ 混合并配成溶液,向溶液中滴加 0.1 mol/L 稀盐酸。下列图像(图丙)能正确表示加入盐酸的体积和生成 CO₂ 的物质的量的关系的是__________(填字母)。


已知:沉淀池中的反应原理如下:
ⅰ. NH₃ + CO₂ + H₂O = NH₄HCO₃
ⅱ. NaCl + NH₄HCO₃ = NaHCO₃↓ + NH₄Cl
(1)“侯氏制碱法”中的“碱”为__________(填化学式);写出煅烧炉中反应的化学方程式:________________________。
(2)在饱和食盐水中先通入 NH₃,再通入 CO₂,这样操作的目的是________________________。
(3)从“母液”中可得到的副产品为__________,用途是__________(任写一种)。
(4)“循环Ⅱ”中参与循环的物质除水外还有__________。
(5)常温下,在 10 mL 0.1 mol/L Na₂CO₃ 溶液中逐滴加入 0.1 mol/L HCl 溶液 20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液 pH 变化的部分情况如图乙所示。回答下列问题:

①在同一溶液中,三种含碳微粒 CO₃²⁻、HCO₃⁻、H₂CO₃__________(填“能”或“不能”)大量共存。
②将 0.84 g NaHCO₃ 和 1.06 g Na₂CO₃ 混合并配成溶液,向溶液中滴加 0.1 mol/L 稀盐酸。下列图像(图丙)能正确表示加入盐酸的体积和生成 CO₂ 的物质的量的关系的是__________(填字母)。

答案:
18. (14分)
(1)Na₂CO₃ (1分) 2NaHCO₃ = Na₂CO₃ + H₂O + CO₂↑ (2分)
(2)先通入NH₃,使溶液呈碱性,能吸收大量CO₂,增大HCO₃⁻的浓度,有利于析出更多的NaHCO₃ (合理即可,2分)
(3)NH₄Cl (2分) 作肥料 (合理即可,1分)
(4)CO₂ (2分)
(5)①不能 (2分) ②D (2分)
侯氏制碱法、碳酸钠和碳酸氢钠的性质
【解析】
(1)“侯氏制碱法”中的“碱”为纯碱,即Na₂CO₃;进入煅烧炉中的沉淀为碳酸氢钠,可以受热分解生成碳酸钠、二氧化碳和水。
(2)因为氨气在水中溶解度较大,且CO₂在碱性溶液中溶解度更大,所以向饱和食盐水中通入氨气使溶液呈碱性,再通入过量CO₂,可以得到浓度较大的HCO₃⁻。
(3)根据题给沉淀池中的反应原理推知,“母液”中可得到的副产品为NH₄Cl,能用作氮肥。
(4)煅烧过程中产生CO₂,因此进入“循环Ⅱ”的物质还有CO₂。
(5)①由图乙可知,Na₂CO₃先与盐酸反应生成NaHCO₃,接近pH = 8时,反应完全;然后再滴入盐酸,NaHCO₃逐步转化为H₂CO₃,可看出CO₃²⁻与H₂CO₃在图乙中处于“有你无我”的状态,由此可知,在同一溶液中,CO₃²⁻、HCO₃⁻、H₂CO₃不能大量共存。②0.84 g NaHCO₃和1.06 g Na₂CO₃的物质的量均为0.01 mol,向二者混合溶液中滴加稀盐酸,起始发生反应为HCl + Na₂CO₃ = NaHCO₃ + NaCl,不放出CO₂,Na₂CO₃完全反应时,消耗0.1 mol/L的盐酸0.1 L,生成0.01 mol NaHCO₃,此时溶液中含有0.02 mol NaHCO₃;再加入盐酸发生反应:HCl + NaHCO₃ = NaCl + CO₂↑ + H₂O,产生CO₂,0.02 mol NaHCO₃完全反应需要0.2 L盐酸,即滴加盐酸至0.3 L时产生CO₂达到最大量,故选D。
(1)Na₂CO₃ (1分) 2NaHCO₃ = Na₂CO₃ + H₂O + CO₂↑ (2分)
(2)先通入NH₃,使溶液呈碱性,能吸收大量CO₂,增大HCO₃⁻的浓度,有利于析出更多的NaHCO₃ (合理即可,2分)
(3)NH₄Cl (2分) 作肥料 (合理即可,1分)
(4)CO₂ (2分)
(5)①不能 (2分) ②D (2分)
侯氏制碱法、碳酸钠和碳酸氢钠的性质
【解析】
(1)“侯氏制碱法”中的“碱”为纯碱,即Na₂CO₃;进入煅烧炉中的沉淀为碳酸氢钠,可以受热分解生成碳酸钠、二氧化碳和水。
(2)因为氨气在水中溶解度较大,且CO₂在碱性溶液中溶解度更大,所以向饱和食盐水中通入氨气使溶液呈碱性,再通入过量CO₂,可以得到浓度较大的HCO₃⁻。
(3)根据题给沉淀池中的反应原理推知,“母液”中可得到的副产品为NH₄Cl,能用作氮肥。
(4)煅烧过程中产生CO₂,因此进入“循环Ⅱ”的物质还有CO₂。
(5)①由图乙可知,Na₂CO₃先与盐酸反应生成NaHCO₃,接近pH = 8时,反应完全;然后再滴入盐酸,NaHCO₃逐步转化为H₂CO₃,可看出CO₃²⁻与H₂CO₃在图乙中处于“有你无我”的状态,由此可知,在同一溶液中,CO₃²⁻、HCO₃⁻、H₂CO₃不能大量共存。②0.84 g NaHCO₃和1.06 g Na₂CO₃的物质的量均为0.01 mol,向二者混合溶液中滴加稀盐酸,起始发生反应为HCl + Na₂CO₃ = NaHCO₃ + NaCl,不放出CO₂,Na₂CO₃完全反应时,消耗0.1 mol/L的盐酸0.1 L,生成0.01 mol NaHCO₃,此时溶液中含有0.02 mol NaHCO₃;再加入盐酸发生反应:HCl + NaHCO₃ = NaCl + CO₂↑ + H₂O,产生CO₂,0.02 mol NaHCO₃完全反应需要0.2 L盐酸,即滴加盐酸至0.3 L时产生CO₂达到最大量,故选D。
查看更多完整答案,请扫码查看


