2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
30. (4 分)阅读下面一段材料并回答问题。
钪是一种稀土金属元素。天然稳定同位素为$^{45}$Sc,化合物常见价态为 +3。钪非常活泼,室温时表面被氧化形成薄膜。Sc₂O₃溶于酸生成 Sc³⁺,溶于过量浓 NaOH 溶液生成 Na₃[Sc(OH)₆]。在氩气保护下,将 ScCl₃和金属 Ca 在高温下反应,再分离熔渣 CaCl₂,可制得纯度约为 99%的金属钪。
钪的熔点比铝的高 2.5 倍,而密度相近,适用于航空、火箭和宇宙飞船的结构材料。钪是有效的合金元素,加入镁或钛中形成合金,可使合金有较好的机械、电学和稳定性能。
判断下列说法是否正确(填“对”或“错”)。
(1)Sc₂O₃具有一定两性氧化物特征。______
(2)ScCl₃与 Ca 制备 Sc 的反应是复分解反应。______
(3)制备 Sc 采用氩气保护可以防止 Sc 和 Ca 被空气氧化。______
(4)钪加入镁中形成合金后,合金的性能与纯金属有差异。______
钪是一种稀土金属元素。天然稳定同位素为$^{45}$Sc,化合物常见价态为 +3。钪非常活泼,室温时表面被氧化形成薄膜。Sc₂O₃溶于酸生成 Sc³⁺,溶于过量浓 NaOH 溶液生成 Na₃[Sc(OH)₆]。在氩气保护下,将 ScCl₃和金属 Ca 在高温下反应,再分离熔渣 CaCl₂,可制得纯度约为 99%的金属钪。
钪的熔点比铝的高 2.5 倍,而密度相近,适用于航空、火箭和宇宙飞船的结构材料。钪是有效的合金元素,加入镁或钛中形成合金,可使合金有较好的机械、电学和稳定性能。
判断下列说法是否正确(填“对”或“错”)。
(1)Sc₂O₃具有一定两性氧化物特征。______
(2)ScCl₃与 Ca 制备 Sc 的反应是复分解反应。______
(3)制备 Sc 采用氩气保护可以防止 Sc 和 Ca 被空气氧化。______
(4)钪加入镁中形成合金后,合金的性能与纯金属有差异。______
答案:
30.(4分,每空1分)
(1)对
(2)错
(3)对
(4)对
Sc及其化合物的性质
【解析】
(1)根据题给信息可知Sc₂O₃既能与酸反应又能与浓NaOH溶液反应,说明具有一定两性氧化物的特征。
(2)ScCl₃与Ca反应生成Sc和CaCl₂,属于置换反应,不是复分解反应。
(3)Sc和Ca都易被氧气氧化,所以制备Sc采用氩气保护,可以防止Sc和Ca被空气氧化。
(4)金属形成合金后,合金的性能与纯金属有差异。
(1)对
(2)错
(3)对
(4)对
Sc及其化合物的性质
【解析】
(1)根据题给信息可知Sc₂O₃既能与酸反应又能与浓NaOH溶液反应,说明具有一定两性氧化物的特征。
(2)ScCl₃与Ca反应生成Sc和CaCl₂,属于置换反应,不是复分解反应。
(3)Sc和Ca都易被氧气氧化,所以制备Sc采用氩气保护,可以防止Sc和Ca被空气氧化。
(4)金属形成合金后,合金的性能与纯金属有差异。
31. (6 分)宋代《千里江山图》所用矿物颜料绿松石中含有 CuAl₆(PO₄)₄(OH)₈·5H₂O。
(1)氧元素在元素周期表中的位置是_。
(2)CuAl₆(PO₄)₄(OH)₈·5H₂O 中 H—O 共价键的类型是______(填“极性键”或“非极性键”)。
(3)下列比较 Mg、Al 金属性强弱的方案合理的是______(填序号)。
a. 比较 Mg、Al 分别与水反应的难易程度
b. 比较 Mg、Al 的密度
c. 向 MgCl₂溶液、AlCl₃溶液中分别滴加 NaOH 溶液至过量,比较 Mg(OH)₂、Al(OH)₃的碱性强弱
(4)P 与 N、As 是同主族元素。
①气态氢化物的稳定性:______ > ______ > ______(填序号)。
a. NH₃
b. PH₃
c. AsH₃
②非金属性:P > ______(填“N”或“As”),用原子结构解释原因:_。
(1)氧元素在元素周期表中的位置是_。
(2)CuAl₆(PO₄)₄(OH)₈·5H₂O 中 H—O 共价键的类型是______(填“极性键”或“非极性键”)。
(3)下列比较 Mg、Al 金属性强弱的方案合理的是______(填序号)。
a. 比较 Mg、Al 分别与水反应的难易程度
b. 比较 Mg、Al 的密度
c. 向 MgCl₂溶液、AlCl₃溶液中分别滴加 NaOH 溶液至过量,比较 Mg(OH)₂、Al(OH)₃的碱性强弱
(4)P 与 N、As 是同主族元素。
①气态氢化物的稳定性:______ > ______ > ______(填序号)。
a. NH₃
b. PH₃
c. AsH₃
②非金属性:P > ______(填“N”或“As”),用原子结构解释原因:_。
答案:
31.(6分,除标注外每空1分)
(1)第二周期ⅥA族
(2)极性键
(3)ac
(4)①a b c (共1分) ②As P、As是同主族元素,电子层数:As>P,原子半径:As>P,得电子的能力:P>As,非金属性:P>As
化学键、元素周期表和元素周期律的应用
【解析】
(1)氧的原子序数为8,位于元素周期表的第二周期ⅥA族。
(2)H—O键属于极性键。
(3)金属单质越容易与水反应产生氢气,说明金属性越强,a正确;根据密度大小无法判断金属性强弱,b错误;氢氧化镁不能溶于氢氧化钠溶液,而氢氧化铝能溶于氢氧化钠溶液,说明氢氧化镁的碱性比氢氧化铝强,可推知镁的金属性比铝强,c正确,故选ac。
(4)①元素的非金属性越强,对应简单气态氢化物越稳定,非金属性:N>P>As,所以气态氢化物的稳定性:NH₃>PH₃>AsH₃,即a>b>c。②N、P、As位于同一主族,电子层数:N<P<As,原子半径:N<P<As,所以得电子能力:N>P>As,即非金属性:N>P>As。
【知识拓展】
比较非金属性强弱的常见方法:单质与氢气反应的难易程度、简单氢化物的稳定性、最高价氧化物对应水化物的酸性强弱以及相互之间的置换反应;比较元素金属性强弱的方法:单质与水或与酸反应产生氢气的难易程度、最高价氧化物对应水化物的碱性强弱以及相互之间的置换反应。
(1)第二周期ⅥA族
(2)极性键
(3)ac
(4)①a b c (共1分) ②As P、As是同主族元素,电子层数:As>P,原子半径:As>P,得电子的能力:P>As,非金属性:P>As
化学键、元素周期表和元素周期律的应用
【解析】
(1)氧的原子序数为8,位于元素周期表的第二周期ⅥA族。
(2)H—O键属于极性键。
(3)金属单质越容易与水反应产生氢气,说明金属性越强,a正确;根据密度大小无法判断金属性强弱,b错误;氢氧化镁不能溶于氢氧化钠溶液,而氢氧化铝能溶于氢氧化钠溶液,说明氢氧化镁的碱性比氢氧化铝强,可推知镁的金属性比铝强,c正确,故选ac。
(4)①元素的非金属性越强,对应简单气态氢化物越稳定,非金属性:N>P>As,所以气态氢化物的稳定性:NH₃>PH₃>AsH₃,即a>b>c。②N、P、As位于同一主族,电子层数:N<P<As,原子半径:N<P<As,所以得电子能力:N>P>As,即非金属性:N>P>As。
【知识拓展】
比较非金属性强弱的常见方法:单质与氢气反应的难易程度、简单氢化物的稳定性、最高价氧化物对应水化物的酸性强弱以及相互之间的置换反应;比较元素金属性强弱的方法:单质与水或与酸反应产生氢气的难易程度、最高价氧化物对应水化物的碱性强弱以及相互之间的置换反应。
32. (6 分)某小组探究 Na₂O₂与 H₂O 的反应,实验方案及现象如下:

(1)Ⅰ中 Na₂O₂与 H₂O 反应生成 O₂的化学方程式是_。
(2)证明Ⅰ中反应后的溶液中存在 H₂O₂的实验证据是_。
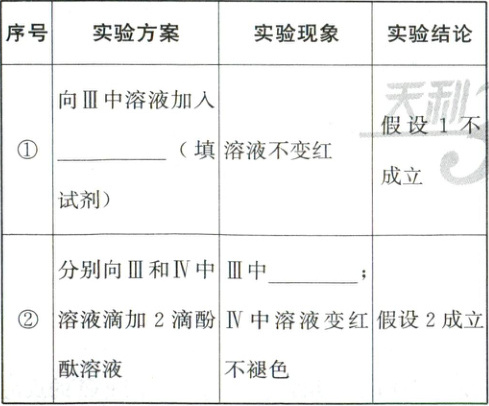
(3)针对Ⅲ中“振荡后溶液红色褪去”提出假设:
已知:ⅰ. 酚酞溶液遇浓 NaOH 溶液先变红后褪色,加水后恢复红色
ⅱ. 一定条件下,酚酞易被强氧化剂氧化
假设 1:溶液中 NaOH 浓度过大,使溶液先变红后褪色;
假设 2:_。
设计如下实验进行探究,请将实验方案、实验现象补充完整。

(1)Ⅰ中 Na₂O₂与 H₂O 反应生成 O₂的化学方程式是_。
(2)证明Ⅰ中反应后的溶液中存在 H₂O₂的实验证据是_。
(3)针对Ⅲ中“振荡后溶液红色褪去”提出假设:
已知:ⅰ. 酚酞溶液遇浓 NaOH 溶液先变红后褪色,加水后恢复红色
ⅱ. 一定条件下,酚酞易被强氧化剂氧化
假设 1:溶液中 NaOH 浓度过大,使溶液先变红后褪色;
假设 2:_。
设计如下实验进行探究,请将实验方案、实验现象补充完整。

答案:
32.(6分,除标注外每空1分)
(1)2Na₂O₂+2H₂O=4NaOH+O₂↑ (2分)
(2)Ⅰ中气泡消失后,加入少量MnO₂,Ⅳ中迅速产生大量气泡
(3)Ⅰ中生成的H₂O₂将酚酞氧化,使溶液褪色 ①H₂O ②溶液先变红后褪色
过氧化钠与水的反应
【解析】
(1)过氧化钠与水反应生成氢氧化钠和氧气。
(2)根据流程可知,当Ⅰ中气泡消失后,再加入少量二氧化锰,Ⅳ中迅速产生大量气泡,由此可推知Ⅰ中反应后的溶液中存在H₂O₂。
(3)结合已知信息推知,溶液红色褪去可能的原因是NaOH浓度过大,或者是Ⅰ中生成的H₂O₂将酚酞氧化,导致溶液褪色。①为了说明不是因为氢氧化钠浓度过大而导致溶液褪色,则可向Ⅲ中溶液加入水,若溶液不变红即可证明。②Ⅲ中含有H₂O₂,而Ⅳ中不含H₂O₂,为了说明是因为H₂O₂把酚酞氧化而导致溶液红色褪去,则可根据Ⅲ中溶液先变红后褪色,Ⅳ中溶液变红后不褪色证明。
(1)2Na₂O₂+2H₂O=4NaOH+O₂↑ (2分)
(2)Ⅰ中气泡消失后,加入少量MnO₂,Ⅳ中迅速产生大量气泡
(3)Ⅰ中生成的H₂O₂将酚酞氧化,使溶液褪色 ①H₂O ②溶液先变红后褪色
过氧化钠与水的反应
【解析】
(1)过氧化钠与水反应生成氢氧化钠和氧气。
(2)根据流程可知,当Ⅰ中气泡消失后,再加入少量二氧化锰,Ⅳ中迅速产生大量气泡,由此可推知Ⅰ中反应后的溶液中存在H₂O₂。
(3)结合已知信息推知,溶液红色褪去可能的原因是NaOH浓度过大,或者是Ⅰ中生成的H₂O₂将酚酞氧化,导致溶液褪色。①为了说明不是因为氢氧化钠浓度过大而导致溶液褪色,则可向Ⅲ中溶液加入水,若溶液不变红即可证明。②Ⅲ中含有H₂O₂,而Ⅳ中不含H₂O₂,为了说明是因为H₂O₂把酚酞氧化而导致溶液红色褪去,则可根据Ⅲ中溶液先变红后褪色,Ⅳ中溶液变红后不褪色证明。
查看更多完整答案,请扫码查看


