2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
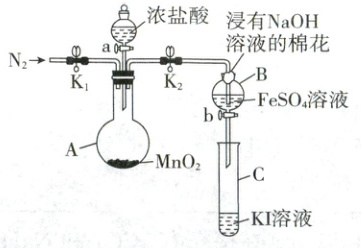
33. (9 分)实验小组用如图装置探究 Cl₂、Fe³⁺、I₂的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
已知:淀粉溶液遇 I₂变蓝
实验过程:
Ⅰ. 打开弹簧夹 K₁和 K₂,通入一段时间 N₂,再将导管插入 B 中,继续通入 N₂一段时间,然后夹紧 K₁;
Ⅱ. 打开活塞 a,滴加一定量浓盐酸后关闭活塞 a,给 A 加热;
Ⅲ. 当 B 中的溶液变为黄色时,停止加热,夹紧 K₂;
Ⅳ. 打开活塞 b,将少量 B 中溶液滴入 C 中,关闭活塞 b。
(1)A 中发生反应的化学方程式是_。
(2)浸有 NaOH 溶液的棉花上发生反应的离子方程式是_。
(3)B 中溶液变黄说明氧化性:Cl₂ > Fe³⁺,反应的离子方程式是_。
(4)为探究 Fe³⁺和 I₂的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 B 中黄色溶液和 C 中混合溶液中的部分微粒,结果如表所示(忽略空气中 O₂的影响)。
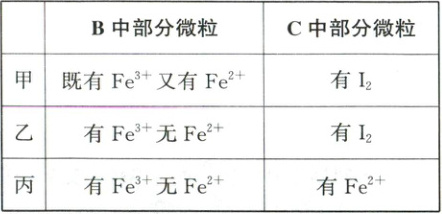
①检验 B 中黄色溶液中含有 Fe³⁺的试剂是______。
②进一步检验 I₂的实验操作及现象是_。
③能证明该实验条件下氧化性 Fe³⁺ > I₂的有______(填“甲”“乙”或“丙”)。不能证明的请说明理由:_。

已知:淀粉溶液遇 I₂变蓝
实验过程:
Ⅰ. 打开弹簧夹 K₁和 K₂,通入一段时间 N₂,再将导管插入 B 中,继续通入 N₂一段时间,然后夹紧 K₁;
Ⅱ. 打开活塞 a,滴加一定量浓盐酸后关闭活塞 a,给 A 加热;
Ⅲ. 当 B 中的溶液变为黄色时,停止加热,夹紧 K₂;
Ⅳ. 打开活塞 b,将少量 B 中溶液滴入 C 中,关闭活塞 b。
(1)A 中发生反应的化学方程式是_。
(2)浸有 NaOH 溶液的棉花上发生反应的离子方程式是_。
(3)B 中溶液变黄说明氧化性:Cl₂ > Fe³⁺,反应的离子方程式是_。
(4)为探究 Fe³⁺和 I₂的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 B 中黄色溶液和 C 中混合溶液中的部分微粒,结果如表所示(忽略空气中 O₂的影响)。

①检验 B 中黄色溶液中含有 Fe³⁺的试剂是______。
②进一步检验 I₂的实验操作及现象是_。
③能证明该实验条件下氧化性 Fe³⁺ > I₂的有______(填“甲”“乙”或“丙”)。不能证明的请说明理由:_。
答案:
33.(9分,除标注外每空1分)
(1)MnO₂+4HCl(浓$) \xlongequal{\triangle} MnCl₂+Cl₂↑+2H₂O (2$分)
(2)Cl₂+2OH⁻=ClO⁻+Cl⁻+H₂O (2分)
(3)Cl₂+2Fe²⁺=2Fe³⁺+2Cl⁻
(4)①KSCN溶液 ②取少量C中混合溶液于试管中,滴加淀粉溶液,溶液变蓝 ③甲、丙 乙中B溶液不含Fe²⁺,则B溶液可能有过量的Cl₂,Cl₂和Fe³⁺均能将I⁻氧化为I₂,C中有I₂生成不能证明氧化性:Fe³⁺>I₂
氯气的制备、氧化性强弱比较
【实验剖析】

【解析】
(1)浓盐酸与二氧化锰共热生成氯化锰、氯气和水,结合守恒规则即可得到化学方程式。
(2)浸有NaOH溶液的棉花用于吸收多余的氯气,发生的反应为氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水。
(3)根据氧化还原反应规律,氧化剂的氧化性强于氧化产物,氯气与Fe²⁺反应生成Fe³⁺和氯离子即可说明氧化性:Cl₂>Fe³⁺。
(4)①利用KSCN溶液遇Fe³⁺变为血红色即可检验B中黄色溶液中含有Fe³⁺。②利用淀粉遇到碘单质,溶液变蓝的特征现象可检验C中混合溶液中含有的I₂。③甲中既有Fe³⁺又有Fe²⁺,则说明B溶液中不含氯气,所以C中含有I₂,可推知是由Fe³⁺氧化I⁻得到,即能证明Fe³⁺的氧化性强于I₂;乙中B溶液不含Fe²⁺,则说明B溶液中可能存在过量的氯气,而氯气和Fe³⁺均能将I⁻氧化为I₂,所以即使C中有I₂生成也不能证明Fe³⁺的氧化性强于I₂;丙中B溶液有Fe³⁺无Fe²⁺,而C中含有Fe²⁺,说明I⁻可以将Fe³⁺还原为Fe²⁺,即可证明Fe³⁺的氧化性强于I₂。
33.(9分,除标注外每空1分)
(1)MnO₂+4HCl(浓$) \xlongequal{\triangle} MnCl₂+Cl₂↑+2H₂O (2$分)
(2)Cl₂+2OH⁻=ClO⁻+Cl⁻+H₂O (2分)
(3)Cl₂+2Fe²⁺=2Fe³⁺+2Cl⁻
(4)①KSCN溶液 ②取少量C中混合溶液于试管中,滴加淀粉溶液,溶液变蓝 ③甲、丙 乙中B溶液不含Fe²⁺,则B溶液可能有过量的Cl₂,Cl₂和Fe³⁺均能将I⁻氧化为I₂,C中有I₂生成不能证明氧化性:Fe³⁺>I₂
氯气的制备、氧化性强弱比较
【实验剖析】

【解析】
(1)浓盐酸与二氧化锰共热生成氯化锰、氯气和水,结合守恒规则即可得到化学方程式。
(2)浸有NaOH溶液的棉花用于吸收多余的氯气,发生的反应为氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水。
(3)根据氧化还原反应规律,氧化剂的氧化性强于氧化产物,氯气与Fe²⁺反应生成Fe³⁺和氯离子即可说明氧化性:Cl₂>Fe³⁺。
(4)①利用KSCN溶液遇Fe³⁺变为血红色即可检验B中黄色溶液中含有Fe³⁺。②利用淀粉遇到碘单质,溶液变蓝的特征现象可检验C中混合溶液中含有的I₂。③甲中既有Fe³⁺又有Fe²⁺,则说明B溶液中不含氯气,所以C中含有I₂,可推知是由Fe³⁺氧化I⁻得到,即能证明Fe³⁺的氧化性强于I₂;乙中B溶液不含Fe²⁺,则说明B溶液中可能存在过量的氯气,而氯气和Fe³⁺均能将I⁻氧化为I₂,所以即使C中有I₂生成也不能证明Fe³⁺的氧化性强于I₂;丙中B溶液有Fe³⁺无Fe²⁺,而C中含有Fe²⁺,说明I⁻可以将Fe³⁺还原为Fe²⁺,即可证明Fe³⁺的氧化性强于I₂。
查看更多完整答案,请扫码查看


