2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
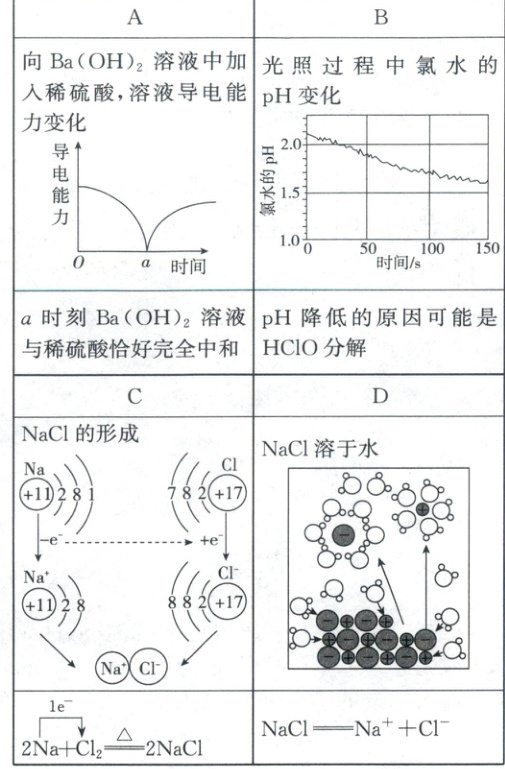
9. 下列对图示的解释不正确的是( )

答案:
9.C溶液导电能力、光照氯水分解、氯化钠的形成、氯化钠溶于水等图示 Ba(OH)₂ + H₂SO₄ = BaSO₄↓ + 2H₂O,随着稀H₂SO₄的加入,生成BaSO₄和H₂O,溶液的导电能力降低,a点Ba(OH)₂和H₂SO₄恰好完全中和,导电能力几乎为0,继续加入稀H₂SO₄,溶液中离子浓度增大,导电能力增大,A正确;光照过程中氯水中的次氯酸分解生成盐酸和氧气,溶液酸性增强,pH减小,B正确;由图可知,氯化钠的形成过程为Na失去一个电子形成Na⁺,Cl得到一个电子形成Cl⁻,Na⁺与Cl⁻通过离子键形成NaCl,形成过程表示为Na× + ·Cl: → Na⁺[:Cl:]⁻,且用单线桥表示应为2Na + Cl₂ = 2NaCl,C错误;NaCl是可溶性盐,在水中完全电离,电离方程式为NaCl = Na⁺ + Cl⁻,D正确。
10. 下列反应的离子方程式书写正确的是( )
A.大理石与盐酸反应:CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O
B.过氧化钠与水反应:2Na₂O₂ + 2H₂O = 4Na⁺ + 4OH⁻ + O₂↑
C.钠与硫酸铜溶液反应的离子方程式:2Na + Cu²⁺ = 2Na⁺ + Cu
D.将少量 Ba(OH)₂ 溶液滴入碳酸氢钠溶液中:Ba²⁺ + OH⁻ + HCO₃⁻ = H₂O + BaCO₃↓
A.大理石与盐酸反应:CO₃²⁻ + 2H⁺ = CO₂↑ + H₂O
B.过氧化钠与水反应:2Na₂O₂ + 2H₂O = 4Na⁺ + 4OH⁻ + O₂↑
C.钠与硫酸铜溶液反应的离子方程式:2Na + Cu²⁺ = 2Na⁺ + Cu
D.将少量 Ba(OH)₂ 溶液滴入碳酸氢钠溶液中:Ba²⁺ + OH⁻ + HCO₃⁻ = H₂O + BaCO₃↓
答案:
10.B离子方程式正误判断 大理石的主要成分是CaCO₃,为难溶物,不能拆,A错误;过氧化钠与水反应生成氢氧化钠和氧气,离子方程式正确,B正确;钠加入硫酸铜溶液中,钠先与水反应生成NaOH和H₂,然后NaOH和CuSO₄反应生成Cu(OH)₂沉淀和Na₂SO₄,C错误;易错点少量Ba(OH)₂溶液滴入碳酸氢钠溶液中,Ba²⁺和OH⁻按1:2完全反应,D错误。
技巧点拨:与量有关的离子方程式书写:理清反应物粒子之间的关系,书写离子方程式时以量少的物质为基准,让量少的物质充分反应,量多的物质根据量少的物质进行确定。在离子方程式中量少的物质充分反应,所以化学计量数之比为化学式中离子数之比,如本题D项中“少量Ba(OH)₂”,则离子方程式中Ba²⁺与OH⁻化学计量数之比为1:2,可快速判断正误。
技巧点拨:与量有关的离子方程式书写:理清反应物粒子之间的关系,书写离子方程式时以量少的物质为基准,让量少的物质充分反应,量多的物质根据量少的物质进行确定。在离子方程式中量少的物质充分反应,所以化学计量数之比为化学式中离子数之比,如本题D项中“少量Ba(OH)₂”,则离子方程式中Ba²⁺与OH⁻化学计量数之比为1:2,可快速判断正误。
11. 将 SO₂ 气体与足量 Fe₂(SO₄)₃ 溶液完全反应后,再加入 K₂Cr₂O₇ 溶液,发生如下两个化学反应:SO₂ + 2Fe³⁺ + 2H₂O = SO₄²⁻ + 2Fe²⁺ + 4H⁺;Cr₂O₇²⁻ + 6Fe²⁺ + 14H⁺ = 2Cr³⁺ + 6Fe³⁺ + 7H₂O,有关说法正确的是( )
A.还原性:Cr³⁺ > Fe²⁺ > SO₂
B.氧化性:Cr₂O₇²⁻ > SO₄²⁻ > Fe³⁺
C.两个反应中 Fe₂(SO₄)₃ 均作还原剂
D.Cr₂O₇²⁻ 能将 SO₂ 氧化成 SO₄²⁻
A.还原性:Cr³⁺ > Fe²⁺ > SO₂
B.氧化性:Cr₂O₇²⁻ > SO₄²⁻ > Fe³⁺
C.两个反应中 Fe₂(SO₄)₃ 均作还原剂
D.Cr₂O₇²⁻ 能将 SO₂ 氧化成 SO₄²⁻
答案:
11.D氧化还原反应基本概念和规律 第一个反应中SO₂失电子作还原剂,生成的SO₄²⁻为氧化产物,Fe³⁺得电子作氧化剂,生成的Fe²⁺为还原产物,则氧化性:Fe³⁺>SO₄²⁻,还原性:SO₂>Fe²⁺,同理可知Cr₂O₇²⁻的氧化性强于Fe³⁺,Fe²⁺的还原性强于Cr³⁺。由以上分析可知,还原性:SO₂>Fe²⁺>Cr³⁺,A错误;氧化性:Cr₂O₇²⁻>Fe³⁺>SO₄²⁻,B错误;第一个反应中硫酸铁为氧化剂,第二个反应中硫酸铁为氧化产物,C错误;氧化性:Cr₂O₇²⁻>Fe³⁺>SO₄²⁻,Fe³⁺能将SO₂氧化成SO₄²⁻,则Cr₂O₇²⁻也能将SO₂氧化成SO₄²⁻,D正确。
12. 下列有关 Na₂CO₃ 和 NaHCO₃ 的说法正确的是( )
A.除去 NaHCO₃ 固体中的 Na₂CO₃ 可以采用加热的方式
B.可用 Ba(OH)₂ 溶液鉴别碳酸钠和碳酸氢钠
C.将标准状况下 11.2 L CO₂ 通入含有 0.6 mol NaOH 的溶液,所得混合液中 Na₂CO₃ 和 NaHCO₃ 的物质的量之比为 1∶4
D.等质量的 Na₂CO₃ 和 NaHCO₃ 与盐酸反应,消耗 HCl 的物质的量:Na₂CO₃ < NaHCO₃
A.除去 NaHCO₃ 固体中的 Na₂CO₃ 可以采用加热的方式
B.可用 Ba(OH)₂ 溶液鉴别碳酸钠和碳酸氢钠
C.将标准状况下 11.2 L CO₂ 通入含有 0.6 mol NaOH 的溶液,所得混合液中 Na₂CO₃ 和 NaHCO₃ 的物质的量之比为 1∶4
D.等质量的 Na₂CO₃ 和 NaHCO₃ 与盐酸反应,消耗 HCl 的物质的量:Na₂CO₃ < NaHCO₃
答案:
12.CNa₂CO₃和NaHCO₃的性质 碳酸氢钠受热分解,不能达到除杂目的,A错误;Na₂CO₃和NaHCO₃都能与Ba(OH)₂反应生成BaCO₃白色沉淀,B错误;2NaOH + CO₂ = Na₂CO₃ + H₂O,Na₂CO₃ + H₂O + CO₂ = 2NaHCO₃,将标准状况下11.2L(即0.5mol)CO₂通入含0.6molNaOH的溶液中,先消耗0.3molCO₂,与0.6molNaOH恰好完全反应转化为0.3molNa₂CO₃,剩余的0.2molCO₂与0.2molNa₂CO₃反应生成0.4molNaHCO₃,则混合液中Na₂CO₃和NaHCO₃的物质的量之比为1:4,C正确;根据反应Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑,NaHCO₃ + HCl = NaCl + H₂O + CO₂↑可得,消耗等物质的量的HCl时,需要的碳酸氢钠的质量更多,则等质量的碳酸钠和碳酸氢钠与盐酸反应,消耗盐酸的物质的量:Na₂CO₃>NaHCO₃,D错误。
13. 已知反应:2NaClO₃ + 4HCl = 2ClO₂↑ + Cl₂↑ + 2NaCl + 2H₂O,下列关于该反应说法不正确的是( )
A.氧化性:NaClO₃ > Cl₂
B.当反应中有 2 mol e⁻ 转移时,被氧化的 HCl 为 4 mol
C.氧化产物和还原产物的物质的量之比为 1∶2
D.产物可以用于自来水消毒杀菌是因为 ClO₂ 有强氧化性
A.氧化性:NaClO₃ > Cl₂
B.当反应中有 2 mol e⁻ 转移时,被氧化的 HCl 为 4 mol
C.氧化产物和还原产物的物质的量之比为 1∶2
D.产物可以用于自来水消毒杀菌是因为 ClO₂ 有强氧化性
答案:
13.B氧化还原反应的基本概念和计算
【信息转化】NaClO₃中Cl为 + 5价,反应中Cl元素化合价降低,被还原,NaClO₃作氧化剂,对应的ClO₂是还原产物;氯化氢中Cl为 - 1价,反应中Cl元素化合价升高,被氧化,HCl作还原剂,对应的Cl₂是氧化产物。
根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性:NaClO₃>Cl₂,A正确;氯化氢中Cl由 - 1价升高到0价,当反应中有2mole⁻转移时,被氧化的HCl为2mol,B错误;氧化产物Cl₂与还原产物ClO₂的物质的量之比为1:2,C正确;产物ClO₂具有强氧化性,可以用于自来水消毒杀菌,D正确。
【信息转化】NaClO₃中Cl为 + 5价,反应中Cl元素化合价降低,被还原,NaClO₃作氧化剂,对应的ClO₂是还原产物;氯化氢中Cl为 - 1价,反应中Cl元素化合价升高,被氧化,HCl作还原剂,对应的Cl₂是氧化产物。
根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则氧化性:NaClO₃>Cl₂,A正确;氯化氢中Cl由 - 1价升高到0价,当反应中有2mole⁻转移时,被氧化的HCl为2mol,B错误;氧化产物Cl₂与还原产物ClO₂的物质的量之比为1:2,C正确;产物ClO₂具有强氧化性,可以用于自来水消毒杀菌,D正确。
14. 某固体可能含有 Na⁺、Ba²⁺、NH₄⁺、Cl⁻、CO₃²⁻、SO₄²⁻ 中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水,加入足量 BaCl₂ 溶液,得沉淀 2.33 g;过滤后加盐酸沉淀不溶解。
(2)另一份固体溶于水,与过量 NaOH 溶液混合后充分加热,只产生使湿润的红色石蕊试纸变蓝色的气体(NH₃)0.672 L(标准状况)。已知 NH₄⁺ + OH⁻ $\xlongequal{\triangle}$ NH₃↑ + H₂O。
下列说法正确的是( )
A.该固体中一定含有 NH₄⁺、Cl⁻、SO₄²⁻、Na⁺
B.根据以上实验,无法确定该固体中是否含有 Cl⁻
C.Cl⁻ 一定存在且 $ n(Cl^-) \geq 0.01 $ mol
D.该固体中一定没有 Na⁺、Ba²⁺、CO₃²⁻
(1)一份固体溶于水,加入足量 BaCl₂ 溶液,得沉淀 2.33 g;过滤后加盐酸沉淀不溶解。
(2)另一份固体溶于水,与过量 NaOH 溶液混合后充分加热,只产生使湿润的红色石蕊试纸变蓝色的气体(NH₃)0.672 L(标准状况)。已知 NH₄⁺ + OH⁻ $\xlongequal{\triangle}$ NH₃↑ + H₂O。
下列说法正确的是( )
A.该固体中一定含有 NH₄⁺、Cl⁻、SO₄²⁻、Na⁺
B.根据以上实验,无法确定该固体中是否含有 Cl⁻
C.Cl⁻ 一定存在且 $ n(Cl^-) \geq 0.01 $ mol
D.该固体中一定没有 Na⁺、Ba²⁺、CO₃²⁻
答案:
14.C离子反应和离子推断
【思路分析】
(1)一份固体溶于水,加入足量BaCl₂溶液,得2.33g沉淀,在沉淀中加入过量盐酸,沉淀不溶解,则说明2.33g沉淀为硫酸钡,所以固体中n(SO₄²⁻) = 2.33g / 233g/mol = 0.01mol,则固体中一定不含Ba²⁺、CO₃²⁻;
(2)另一份固体溶于水,与过量NaOH溶液混合后充分加热,只产生0.672LNH₃(标准状况),则n(NH₄⁺) = 0.672L / 22.4L/mol = 0.03mol,根据溶液呈电中性,则固体中一定含Cl⁻,不能确定是否含Na⁺,由此解答。
由以上分析可知,该固体中一定含有NH₄⁺、Cl⁻、SO₄²⁻,不能确定是否含有Na⁺,A、B错误;固体含0.01molSO₄²⁻、0.03molNH₄⁺和一定量的Cl⁻,不能确定是否含有Na⁺,根据溶液呈电中性,n(Cl⁻) ≥ 0.01mol,C正确;根据以上分析,可确定该固体中可能含Na⁺,D错误。
【思路分析】
(1)一份固体溶于水,加入足量BaCl₂溶液,得2.33g沉淀,在沉淀中加入过量盐酸,沉淀不溶解,则说明2.33g沉淀为硫酸钡,所以固体中n(SO₄²⁻) = 2.33g / 233g/mol = 0.01mol,则固体中一定不含Ba²⁺、CO₃²⁻;
(2)另一份固体溶于水,与过量NaOH溶液混合后充分加热,只产生0.672LNH₃(标准状况),则n(NH₄⁺) = 0.672L / 22.4L/mol = 0.03mol,根据溶液呈电中性,则固体中一定含Cl⁻,不能确定是否含Na⁺,由此解答。
由以上分析可知,该固体中一定含有NH₄⁺、Cl⁻、SO₄²⁻,不能确定是否含有Na⁺,A、B错误;固体含0.01molSO₄²⁻、0.03molNH₄⁺和一定量的Cl⁻,不能确定是否含有Na⁺,根据溶液呈电中性,n(Cl⁻) ≥ 0.01mol,C正确;根据以上分析,可确定该固体中可能含Na⁺,D错误。
15. 在酸性条件下,黄铁矿(FeS₂)催化氧化的离子方程式为 2FeS₂ + 7O₂ + 2H₂O = 2Fe²⁺ + 4SO₄²⁻ + 4H⁺。实现该反应的物质间转化如图所示。下列分析不正确的是( )
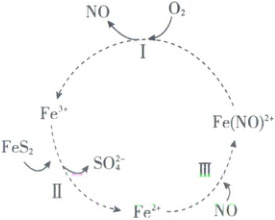
A.反应Ⅰ的离子方程式为 4Fe(NO)²⁺ + O₂ + 4H⁺ = 4Fe³⁺ + 4NO + 2H₂O
B.反应Ⅱ的氧化剂是 FeS₂
C.反应Ⅲ的离子方程式为 Fe²⁺ + NO = Fe(NO)²⁺
D.在酸性条件下,黄铁矿催化氧化中 NO 作催化剂

A.反应Ⅰ的离子方程式为 4Fe(NO)²⁺ + O₂ + 4H⁺ = 4Fe³⁺ + 4NO + 2H₂O
B.反应Ⅱ的氧化剂是 FeS₂
C.反应Ⅲ的离子方程式为 Fe²⁺ + NO = Fe(NO)²⁺
D.在酸性条件下,黄铁矿催化氧化中 NO 作催化剂
答案:
15.B黄铁矿催化氧化反应 由图可知反应Ⅰ过程中:Fe(NO)²⁺中铁元素化合价升高,氧气中氧元素化合价降低,反应的离子方程式为4Fe(NO)²⁺ + O₂ + 4H⁺ = 4Fe³⁺ + 4NO + 2H₂O,A正确;反应Ⅱ中Fe元素由 + 3价变成 + 2价,反应Ⅱ中Fe³⁺是氧化剂,B错误;反应Ⅲ中无元素化合价变化,所以反应Ⅲ是非氧化还原反应,离子方程式为Fe²⁺ + NO = Fe(NO)²⁺,C正确;NO与Fe²⁺反应生成Fe(NO)²⁺,Fe(NO)²⁺被O₂氧化为Fe³⁺,同时又生成NO,则黄铁矿催化氧化中NO作催化剂,D正确。
查看更多完整答案,请扫码查看


