2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套高中名校期中期末联考测试卷高中化学必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
9. 已知 NA 是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,4.48 L CO₂ 和 O₂ 组成的混合气体中含有的氧原子数为 0.2NA
B.相同温度和压强下,等质量的 CO、CO₂ 气体分子数之比为 11∶7
C.1 mol NH₄⁺ 所含质子数为 10NA
D.标准状况下,11.2 L Cl₂ 溶于水,溶液中 Cl⁻、ClO⁻ 和 HClO 的微粒数之和为 NA
A.标准状况下,4.48 L CO₂ 和 O₂ 组成的混合气体中含有的氧原子数为 0.2NA
B.相同温度和压强下,等质量的 CO、CO₂ 气体分子数之比为 11∶7
C.1 mol NH₄⁺ 所含质子数为 10NA
D.标准状况下,11.2 L Cl₂ 溶于水,溶液中 Cl⁻、ClO⁻ 和 HClO 的微粒数之和为 NA
答案:
9. B阿伏加德罗常数的应用 每个二氧化碳和氧气分子中都含有2个氧原子,且标准状况下4.48L混合气体的物质的量为0.2mol,所以混合气体中含有的氧原子数为0.4N_A,A错误;等质量的一氧化碳和二氧化碳气体分子数之比为$\frac{1}{28} : \frac{1}{44} = 11:7,$B正确;每个NH₄⁺含有11个质子,则1molNH₄⁺含有的质子数为11N_A,C错误;由物料守恒可知,氯水中$n(Cl⁻) + n(ClO⁻) + n(HClO) + 2n(Cl₂) = \frac{11.2}{22.4}×2 mol = 1 mol,$故溶液中Cl⁻、ClO⁻和HClO的微粒数之和小于N_A,D错误。
10. 下列各组物质的转化关系能全部通过一步反应完成的是( )
A.C→CO₂→CaCO₃→Ca(OH)₂
B.Fe→FeCl₂→Fe₂O₃→Fe(OH)₃
C.Na→NaOH→Na₂CO₃→NaCl
D.Cu→CuO→Cu(OH)₂→CuSO₄
A.C→CO₂→CaCO₃→Ca(OH)₂
B.Fe→FeCl₂→Fe₂O₃→Fe(OH)₃
C.Na→NaOH→Na₂CO₃→NaCl
D.Cu→CuO→Cu(OH)₂→CuSO₄
答案:
10. C物质的性质与转化 CaCO₃→Ca(OH)₂的转化不能一步实现,A错误;FeCl₂→Fe₂O₃和Fe₂O₃→Fe(OH)₃的转化不能一步实现,B错误;钠和水反应生成NaOH,NaOH和CO₂反应生成Na₂CO₃,Na₂CO₃和盐酸反应生成氯化钠,故均能一步反应完成,C正确;CuO→Cu(OH)₂的转化不能一步实现,D错误。
11. 过氧化钠与气态非金属氧化物反应有如下规律:与最高价气态非金属氧化物反应能生成盐,放出氧气(如反应①),与次高价气态非金属氧化物反应能直接化合生成盐,不放出氧气(如反应②,下列化学方程式均未配平)。
①Na₂O₂ + CO₂ → Na₂CO₃ + O₂
②Na₂O₂ + CO → Na₂CO₃
下列说法正确的是( )
A.反应①属于氧化还原反应,反应②不属于氧化还原反应
B.转移相等的电子时,反应①与反应②消耗的 Na₂O₂ 的质量比为 2∶1
C.根据题中规律,可推知 Na₂O₂ + SO₂ → Na₂SO₄ + O₂(未配平)
D.反应①中 Na₂CO₃ 是氧化产物,反应②中 Na₂CO₃ 既是氧化产物又是还原产物
①Na₂O₂ + CO₂ → Na₂CO₃ + O₂
②Na₂O₂ + CO → Na₂CO₃
下列说法正确的是( )
A.反应①属于氧化还原反应,反应②不属于氧化还原反应
B.转移相等的电子时,反应①与反应②消耗的 Na₂O₂ 的质量比为 2∶1
C.根据题中规律,可推知 Na₂O₂ + SO₂ → Na₂SO₄ + O₂(未配平)
D.反应①中 Na₂CO₃ 是氧化产物,反应②中 Na₂CO₃ 既是氧化产物又是还原产物
答案:
11. B过氧化钠的性质、氧化还原反应 反应②中,-1价氧元素化合价降低,碳元素化合价升高,即Na₂O₂是氧化剂,CO是还原剂,该反应属于氧化还原反应,A错误;反应①中,有关系式:Na₂O₂~e⁻,反应②中,有关系式:Na₂O₂~2e⁻,所以转移相等的电子时,反应①与反应②消耗的Na₂O₂的质量比为2:1,B正确;SO₂属于次高价气态非金属氧化物,根据题中规律,可推知Na₂O₂ + SO₂ = Na₂SO₄,C错误;反应①中Na₂CO₃是还原产物,D错误。
12. 为了验证 HClO 见光分解的产物,某实验小组用强光照射氯水,并将 pH 传感器、Cl⁻传感器置于溶液中,O₂ 传感器置于溶液上方,且传感器均与数据采集器连接,得到如图甲、乙、丙所示的曲线(整套装置体系密闭且忽略体系温度变化)。下列说法正确的是( )
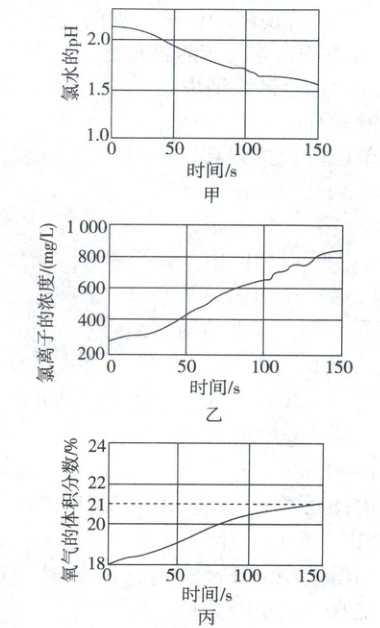
A.随着光照时间的延长,氯水的酸性和氧化性均减弱
B.图乙中,Cl⁻浓度增大说明 HClO 分解生成 HCl,且在通电条件下 HCl 发生了电离
C.由图丙可知,光照可催化水分解
D.结合图甲、乙和丙,分析可知 2HClO $\xlongequal{光照}$ 2HCl + O₂↑

A.随着光照时间的延长,氯水的酸性和氧化性均减弱
B.图乙中,Cl⁻浓度增大说明 HClO 分解生成 HCl,且在通电条件下 HCl 发生了电离
C.由图丙可知,光照可催化水分解
D.结合图甲、乙和丙,分析可知 2HClO $\xlongequal{光照}$ 2HCl + O₂↑
答案:
12. D氯水的性质 次氯酸见光分解生成盐酸和氧气,随着光照时间的延长,氯水的酸性增强,A错误;氯化氢电离不需要通电,B错误;次氯酸分解生成氯化氢和氧气,氧气浓度增大与水的分解无关,C错误;次氯酸不稳定,见光分解生成氯化氢和氧气,D正确。
13. 向 1 mol/L 的硫酸溶液中加入适量 X,加入 X 的质量 [m(X)] 与溶液导电能力的变化关系如图所示,下列说法错误的是( )
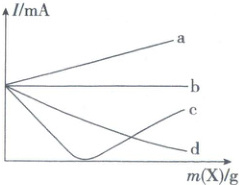
A.曲线 a:X 可能为 NaCl 固体
B.曲线 b:X 可能为 1 mol/L 的 BaCl₂ 溶液
C.曲线 c:X 可能为 1 mol/L 的 Ba(OH)₂ 溶液
D.曲线 d:X 可能为水

A.曲线 a:X 可能为 NaCl 固体
B.曲线 b:X 可能为 1 mol/L 的 BaCl₂ 溶液
C.曲线 c:X 可能为 1 mol/L 的 Ba(OH)₂ 溶液
D.曲线 d:X 可能为水
答案:
13. B离子反应 加入NaCl固体,溶液中自由移动的离子浓度增大,溶液导电能力增强,A正确;加入1mol/L BaCl₂溶液,BaCl₂与H₂SO₄发生反应,反应后溶液中离子所带电荷总量不变,但溶液体积增大,溶液导电能力减弱,B错误;氢氧化钡与硫酸反应生成硫酸钡沉淀和水,溶液导电能力减小到接近于0,继续加入氢氧化钡溶液,溶液导电能力又增强,C正确;加水,溶液体积增加,溶液中自由移动的离子浓度减小,溶液导电能力减弱,D正确。
查看更多完整答案,请扫码查看


