第15页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
4. 为了测定一瓶未密封保存的 NaOH 固体中 NaOH 的质量(只含$ Na_2CO_3$杂质),小金进行了如下操作:①取20g样品于烧杯中,加足量水配成溶液;②再往溶液中加入足量的稀盐酸;③待反应完全后,称量。有关数据记录如下表:
|反应前|反应后|
|烧杯和样品溶液的总质量/g|加入的稀盐酸的质量/g|烧杯和溶液的总质量/g|
|105|200|300.6|

(1)反应共生成气体______g。
(2)该瓶20g样品中所含 NaOH 的质量为多少?
|反应前|反应后|
|烧杯和样品溶液的总质量/g|加入的稀盐酸的质量/g|烧杯和溶液的总质量/g|
|105|200|300.6|

(1)反应共生成气体______g。
(2)该瓶20g样品中所含 NaOH 的质量为多少?
答案:
(1)4.4
(2)设生成4.4g二氧化碳需要碳酸钠的质量为x。
Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑
106 44
x 4.4g
$\frac{106}{44}=\frac{x}{4.4\mathrm{g}}$,解得x=10.6g。
该瓶20g样品中所含NaOH的质量为20g-10.6g=9.4g。
(1)4.4
(2)设生成4.4g二氧化碳需要碳酸钠的质量为x。
Na₂CO₃+2HCl===2NaCl+H₂O+CO₂↑
106 44
x 4.4g
$\frac{106}{44}=\frac{x}{4.4\mathrm{g}}$,解得x=10.6g。
该瓶20g样品中所含NaOH的质量为20g-10.6g=9.4g。
5. 用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行酸碱反应实验时,反应过程中溶液的酸碱度变化如图所示。
(1)该实验是将______(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入溶液的质量为b时,溶液中的溶质有______。
(3)当加入溶液的质量a为20g时,求所得溶液中溶质的质量。
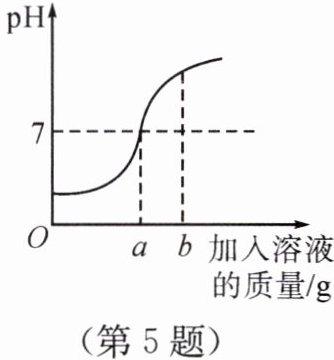
(1)该实验是将______(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入溶液的质量为b时,溶液中的溶质有______。
(3)当加入溶液的质量a为20g时,求所得溶液中溶质的质量。

答案:
(1)氢氧化钠溶液
(2)NaCl、NaOH
(3)设所得溶液中溶质的质量为x。
HCl+NaOH === NaCl+H₂O
40 58.5
20g×10% x
$\frac{40}{20\mathrm{g}× 10\%}=\frac{58.5}{x}$,解得x=2.925g。
(1)氢氧化钠溶液
(2)NaCl、NaOH
(3)设所得溶液中溶质的质量为x。
HCl+NaOH === NaCl+H₂O
40 58.5
20g×10% x
$\frac{40}{20\mathrm{g}× 10\%}=\frac{58.5}{x}$,解得x=2.925g。
6. 某兴趣小组用10g镁条与一定溶质质量分数的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图所示(假设镁条中除表面含有氧化镁外,没有其他杂质)。
(1)图中B点溶液中含有的阳离子有______(用符号表示)。
(2)用化学方程式说明当加入的稀硫酸的质量为10g时,为什么不产生氢气:______。
(3)计算所用稀硫酸的溶质质量分数。

(1)图中B点溶液中含有的阳离子有______(用符号表示)。
(2)用化学方程式说明当加入的稀硫酸的质量为10g时,为什么不产生氢气:______。
(3)计算所用稀硫酸的溶质质量分数。

答案:
(1)Mg²⁺、H⁺
(2)MgO+H₂SO₄===MgSO₄+H₂O
(3)根据图像可知,与镁反应生成氢气的稀硫酸的质量为70g-20g=50g,生成氢气0.2g。
设稀硫酸的溶质质量分数为x。
Mg+H₂SO₄===MgSO₄+H₂↑
98 2
50g×x 0.2g
$\frac{98}{2}=\frac{50\mathrm{g}× x}{0.2\mathrm{g}}$,解得x=19.6%。
(1)Mg²⁺、H⁺
(2)MgO+H₂SO₄===MgSO₄+H₂O
(3)根据图像可知,与镁反应生成氢气的稀硫酸的质量为70g-20g=50g,生成氢气0.2g。
设稀硫酸的溶质质量分数为x。
Mg+H₂SO₄===MgSO₄+H₂↑
98 2
50g×x 0.2g
$\frac{98}{2}=\frac{50\mathrm{g}× x}{0.2\mathrm{g}}$,解得x=19.6%。
查看更多完整答案,请扫码查看


