第76页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1 [2024江苏常州中考]乙烷和二氧化碳反应制乙烯(${C_{2}H_{4}}$)有助于实现“碳中和”,其反应微观示意图如下(相同小球表示同种原子),下列说法不正确的是 (
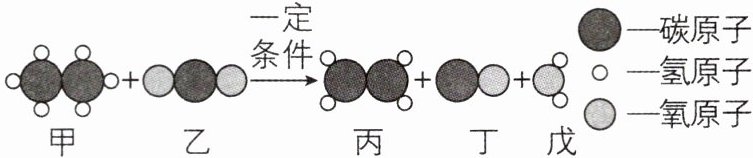
A.甲的化学式为${C_{2}H_{6}}$
B.参加反应的甲、乙质量比为$1:1$
C.分子的种类发生改变
D.丙与丁的分子个数之比为$1:1$
B
)
A.甲的化学式为${C_{2}H_{6}}$
B.参加反应的甲、乙质量比为$1:1$
C.分子的种类发生改变
D.丙与丁的分子个数之比为$1:1$
答案:
B
在一次实验课上,同学们通过小组合作,完成了对密闭容器中少量小苏打与少量白醋反应的质量测定(化学方程式为${CH_{3}COOH + NaHCO_{3} \xlongequal{} H_{2}O + CO_{2} \uparrow + CH_{3}COONa}$)。以下分析正确的是 (
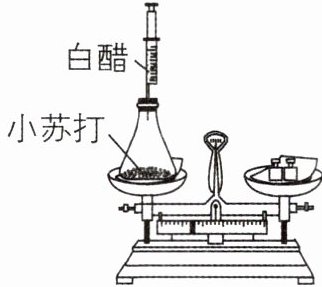
A.反应后小苏打的质量增加
B.反应过程中各物质的质量都不变
C.反应前后各物质的质量总和相等
D.反应前称量的是小苏打和白醋的总质量
C
)
A.反应后小苏打的质量增加
B.反应过程中各物质的质量都不变
C.反应前后各物质的质量总和相等
D.反应前称量的是小苏打和白醋的总质量
答案:
C 【解析】
白醋的主要成分是醋酸,小苏打是碳酸氢钠的俗称,醋酸能与碳酸氢钠反应生成醋酸钠、二氧化碳和水,所以反应后小苏打的质量减少,反应过程中各物质的质量改变,A、B错误
根据质量守恒定律,参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等,即反应前后各物质的质量总和相等,C正确
反应前称量的是小苏打和白醋以及装置的总质量,D错误
白醋的主要成分是醋酸,小苏打是碳酸氢钠的俗称,醋酸能与碳酸氢钠反应生成醋酸钠、二氧化碳和水,所以反应后小苏打的质量减少,反应过程中各物质的质量改变,A、B错误
根据质量守恒定律,参加化学反应的各物质质量总和与反应后生成的各物质质量总和相等,即反应前后各物质的质量总和相等,C正确
反应前称量的是小苏打和白醋以及装置的总质量,D错误
3 [2024江苏无锡中考]可燃物$\text{R}$由碳、氢、氧中的一种或几种元素组成。一定质量的$\text{R}$和氧气在密闭容器中燃烧,反应前后各物质的质量如表。
|物质|$\text{R}$|氧气|二氧化碳|水|一氧化碳|
|反应前质量/g|$m_{1}$|$m_{2}$|$0$|$0$|$0$|
|反应后质量/g|$0$|$0$|$m_{3}$|$m_{4}$|$m_{5}$|
下列叙述错误的是 (
A.$m_{3}= 0$,$m_{5}= 0$时,$\text{R}$中一定含有氢元素
B.$m_{1}+m_{2}= m_{3}$时,$\text{R}$中一定含有碳元素,可能含有氧元素
C.$m_{3}:m_{4}= 11:9$时,$\text{R}$中一定含有碳元素和氢元素,可能含有氧元素
D.$\frac{8}{11}m_{3}+\frac{8}{9}m_{4}+\frac{4}{7}m_{5}= m_{2}$时,$\text{R}$中一定含有碳、氢、氧三种元素
|物质|$\text{R}$|氧气|二氧化碳|水|一氧化碳|
|反应前质量/g|$m_{1}$|$m_{2}$|$0$|$0$|$0$|
|反应后质量/g|$0$|$0$|$m_{3}$|$m_{4}$|$m_{5}$|
下列叙述错误的是 (
D
)A.$m_{3}= 0$,$m_{5}= 0$时,$\text{R}$中一定含有氢元素
B.$m_{1}+m_{2}= m_{3}$时,$\text{R}$中一定含有碳元素,可能含有氧元素
C.$m_{3}:m_{4}= 11:9$时,$\text{R}$中一定含有碳元素和氢元素,可能含有氧元素
D.$\frac{8}{11}m_{3}+\frac{8}{9}m_{4}+\frac{4}{7}m_{5}= m_{2}$时,$\text{R}$中一定含有碳、氢、氧三种元素
答案:
D 【解析】根据质量守恒定律,化学反应前后元素种类不变,$m_{3}=0$,$m_{5}=0$时,说明R和氧气反应生成水,则说明R中一定含有氢元素,A正确;若$m_{1}+m_{2}=m_{3}$,则说明R和氧气反应生成二氧化碳,则R中一定含有碳元素,可能含有氧元素,B正确;若$m_{3}:m_{4}=11:9$时,说明R和氧气反应生成二氧化碳和水,则R中一定含有碳元素和氢元素,可能含有氧元素,C正确;$m_{3}\ \text{g}$二氧化碳中,氧元素的质量为$(\frac {16×2}{12+16×2}×100\% )×m_{3}\ \text{g}=\frac {8}{11}m_{3}\ \text{g}$,$m_{4}\ \text{g}$水中氧元素质量为$(\frac {16}{1×2+16}×100\% )×m_{4}\ \text{g}=\frac {8}{9}m_{4}\ \text{g}$,$m_{5}\ \text{g}$一氧化碳中氧元素的质量为$(\frac {16}{12+16}×100\% )×m_{5}\ \text{g}=\frac {4}{7}m_{5}\ \text{g}$,若$\frac {8}{11}m_{3}+\frac {8}{9}m_{4}+\frac {4}{7}m_{5}=m_{2}$,则氧气中氧元素的质量等于生成物中氧元素的质量,R中不含氧元素,D错误。
4 [2024黑龙江哈尔滨中考改编]下列有关叙述对应的化学方程式、所属的基本反应类型都正确的是 (
A.铁丝在氧气中燃烧:${3Fe + 2O_{2} \xlongequal{点燃} Fe_{3}O_{4}}$ 化合反应
B.用铁桶盛放波尔多液:${Fe + CuSO_{4} \xlongequal{} Cu + FeSO_{4}}$ 分解反应
C.实验室用过氧化氢制氧气:${2H_{2}O_{2} \xlongequal{} H_{2}O + O_{2}}$ 分解反应
D.用红磷测定空气中氧气含量:${P + O_{2} \xlongequal{点燃} P_{2}O_{5}}$ 化合反应
A
)A.铁丝在氧气中燃烧:${3Fe + 2O_{2} \xlongequal{点燃} Fe_{3}O_{4}}$ 化合反应
B.用铁桶盛放波尔多液:${Fe + CuSO_{4} \xlongequal{} Cu + FeSO_{4}}$ 分解反应
C.实验室用过氧化氢制氧气:${2H_{2}O_{2} \xlongequal{} H_{2}O + O_{2}}$ 分解反应
D.用红磷测定空气中氧气含量:${P + O_{2} \xlongequal{点燃} P_{2}O_{5}}$ 化合反应
答案:
A 【解析】该化学方程式书写完全正确,该反应符合“多变一”的特点,属于化合反应,故A选项正确。铁和硫酸铜溶液反应生成硫酸亚铁和铜,该反应不符合“一变多”的特点,不属于分解反应,故B选项错误。过氧化氢在二氧化锰的催化作用下生成水和氧气,正确的化学方程式为${2H2O2\xlongequal{{MnO2}}2H2O{+}O2\uparrow }$,故C选项错误。用红磷测定空气中氧气含量,红磷燃烧的化学方程式是${4P{+}5O2\xlongequal{点燃}2P2O5}$,故D选项错误。
(1)根据反应的化学方程式分析,过氧化氢的质量反应后比反应前
(2)现需要制得$3.2\ \text{g}$氧气,至少需要多少溶质质量分数为$5\%$的过氧化氢溶液(请写出计算过程)。
解:设至少需要溶质质量分数为5%的过氧化氢溶液的质量为x。
${2H2O2\xlongequal{{MnO2}}2H2O{+}O2\uparrow }$
68 32
$x×5\% $ 3.2 g
$\frac {68}{32}=\frac {x×5\% }{3.2\ \text{g}}$
$x = 136\ \text{g}$
答:现需要制得3.2 g氧气,至少需要溶质质量分数为5%的过氧化氢溶液的质量为136 g。
减少
(填“增加”或“减少”)。(2)现需要制得$3.2\ \text{g}$氧气,至少需要多少溶质质量分数为$5\%$的过氧化氢溶液(请写出计算过程)。
解:设至少需要溶质质量分数为5%的过氧化氢溶液的质量为x。
${2H2O2\xlongequal{{MnO2}}2H2O{+}O2\uparrow }$
68 32
$x×5\% $ 3.2 g
$\frac {68}{32}=\frac {x×5\% }{3.2\ \text{g}}$
$x = 136\ \text{g}$
答:现需要制得3.2 g氧气,至少需要溶质质量分数为5%的过氧化氢溶液的质量为136 g。
答案:
(1)减少
(2)解:设至少需要溶质质量分数为5%的过氧化氢溶液的质量为x。
${2H2O2\xlongequal{{MnO2}}2H2O{+}O2\uparrow }$
68 32
$x×5\% $ 3.2 g
$\frac {68}{32}=\frac {x×5\% }{3.2\ \text{g}}$
$x = 136\ \text{g}$
答:现需要制得3.2 g氧气,至少需要溶质质量分数为5%的过氧化氢溶液的质量为136 g。
(1)减少
(2)解:设至少需要溶质质量分数为5%的过氧化氢溶液的质量为x。
${2H2O2\xlongequal{{MnO2}}2H2O{+}O2\uparrow }$
68 32
$x×5\% $ 3.2 g
$\frac {68}{32}=\frac {x×5\% }{3.2\ \text{g}}$
$x = 136\ \text{g}$
答:现需要制得3.2 g氧气,至少需要溶质质量分数为5%的过氧化氢溶液的质量为136 g。
查看更多完整答案,请扫码查看


