第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1 将 100 g 20%的氯化钠溶液进行如图处理后,所得溶液的溶质质量分数为 x%,则 x 的值是(
A.5
B.15
C.20
D.25
A
)A.5
B.15
C.20
D.25
答案:
A 【解析】由题图可知,将25 g 20%的氯化钠溶液加水稀释,得到100 g x%的氯化钠溶液,根据溶液稀释前后溶质质量不变,25 g×20%=100 g×x%,x=5。故选A。
2 下列关于饱和溶液与不饱和溶液的叙述,正确的是(
A.稀溶液一定是不饱和溶液
B.浓溶液一定是饱和溶液
C.在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓
D.溶质种类相同的两瓶溶液,溶质质量大的一定是浓溶液
C
)A.稀溶液一定是不饱和溶液
B.浓溶液一定是饱和溶液
C.在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓
D.溶质种类相同的两瓶溶液,溶质质量大的一定是浓溶液
答案:
C 【解析】溶液是否饱和与溶液的浓稀无必然联系,稀溶液不一定是不饱和溶液,浓溶液也不一定是饱和溶液,A、B错误;在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓,C正确;溶液的质量未知,仅根据溶质质量不能判断两种溶液的浓稀,D错误。
3 [中]20℃时,100 g 水最多能溶解 36 g 氯化钠。农业上常用 16%氯化钠溶液选种,不能用生理盐水(0.9%氯化钠溶液)选种,下列说法正确的是(
A.用 16 克氯化钠和 100 克水配制的溶液为 16%氯化钠溶液
B.16%氯化钠溶液中氯化钠比 0.9%氯化钠溶液中氯化钠质量大
C.可以用氯化钠固体和 0.9%氯化钠溶液配制 16%氯化钠溶液
D.20℃时可用 16%氯化钠溶液配制 36%氯化钠溶液
C
)A.用 16 克氯化钠和 100 克水配制的溶液为 16%氯化钠溶液
B.16%氯化钠溶液中氯化钠比 0.9%氯化钠溶液中氯化钠质量大
C.可以用氯化钠固体和 0.9%氯化钠溶液配制 16%氯化钠溶液
D.20℃时可用 16%氯化钠溶液配制 36%氯化钠溶液
答案:
C 【解析】用16克氯化钠和100克水配制的溶液的溶质质量分数为$\frac{16\ \text{g}}{16\ \text{g+100}\ \text{g}}$×100%≈13.8%<16%,故A选项说法错误。不知道溶液的质量,16%氯化钠溶液中氯化钠不一定比0.9%氯化钠溶液中氯化钠质量大,故B选项说法错误。可以用氯化钠固体和0.9%氯化钠溶液配制16%氯化钠溶液,故C选项说法正确。20℃时,氯化钠的溶解度为36克,该温度下饱和溶液中溶质质量分数为$\frac{36\ \text{g}}{36\ \text{g+100}\ \text{g}}$×100%≈26.5%,不可能配制36%的氯化钠溶液,故D选项说法错误。
4 新考法[2025 陕西西安碑林区期末,较难]将一定质量的甲固体加入盛有一定量水的烧杯中,再放入一个小木块,小木块在溶液中排开液体的情况如图所示。已知乙固体溶于水且不与甲发生反应。下列说法正确的是(
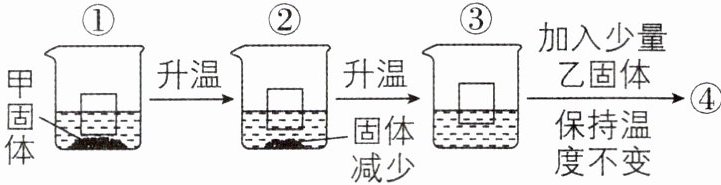
A.甲固体的溶解度随温度升高而减小
B.实验过程中溶液一直为饱和溶液
C.四个烧杯中溶质甲的质量分数为④>③>②>①
D.④中木块位置应高于③中的木块位置
D
)
A.甲固体的溶解度随温度升高而减小
B.实验过程中溶液一直为饱和溶液
C.四个烧杯中溶质甲的质量分数为④>③>②>①
D.④中木块位置应高于③中的木块位置
答案:
D 【解析】将一定质量的甲固体加入盛有一定量水的烧杯中,再放入一个小木块,随着温度的升高,烧杯底部甲固体的质量逐渐减少,③中甲固体完全溶解,说明甲固体的溶解度随温度升高而增大,故A选项说法错误。③中甲固体完全溶解,可能是恰好饱和的溶液,也可能是不饱和溶液,故B选项说法错误。①②③中溶剂质量相等,烧杯中溶解的甲固体的质量①<②<③,则烧杯中溶质甲的质量分数③>②>①;③④中溶解的甲固体的质量相等,但溶液质量③<④,则烧杯中溶质甲的质量分数③>④,故C选项说法错误。再加入少量乙固体,乙固体能继续溶解,④中溶液的密度>③中溶液的密度,$F_{\text{浮}}=\rho_{\text{液}}gV_{\text{排}}$,则④中木块位置应高于③中的木块位置,故D选项说法正确。故选D。
(1)该实验的操作步骤是
(2)两组同学进行配制溶液时分别发生了图 A 和图 B 的错误操作,请分析该操作对实验结果的影响,并改正。A 操作导致所配制溶液的溶质质量分数
(3)如图是$ KNO_3$饱和溶液的溶质质量分数随温度变化的曲线图,若要使 60 g 溶质质量分数为 30%的$ KNO_3$溶液变为 37.5%,采用的方法可以是
计算
、称量、溶解、装瓶存放。(2)两组同学进行配制溶液时分别发生了图 A 和图 B 的错误操作,请分析该操作对实验结果的影响,并改正。A 操作导致所配制溶液的溶质质量分数
偏小
(填“偏大”“偏小”或“不变”);若其他操作都正确,按 A 操作配制的溶液的溶质质量分数为16.7
(答案保留一位小数)%。B 操作导致所配制溶液的溶质质量分数偏大
(填“偏大”“偏小”或“不变”),改正:视线应与量筒内凹液面的最低处
保持水平。(3)如图是$ KNO_3$饱和溶液的溶质质量分数随温度变化的曲线图,若要使 60 g 溶质质量分数为 30%的$ KNO_3$溶液变为 37.5%,采用的方法可以是
ABCD
(多选,填序号)。
答案:
(1)计算
(2)偏小 16.7 偏大 量筒内凹液面的最低处
(3)ABCD
【解析】
(1)配制溶液的一般步骤是计算、称量、溶解、装瓶存放。
(2)配制50 g溶质质量分数为25%的${KNO3}$溶液,需要${KNO3}$的质量为50 g×25%=12.5 g,需要水的质量为50 g-12.5 g=37.5 g。A操作将砝码与${KNO3}$固体的位置放反了,称量时应将砝码放在右盘,${KNO3}$固体放在左盘,所称量的${KNO3}$固体的质量是10 g-2.5 g=7.5 g,溶质的质量偏小,则导致溶质质量分数偏小;若其他操作都正确,按A操作配制的溶液的溶质质量分数为$\frac{7.5\ \text{g}}{37.5\ \text{g+7.5}\ \text{g}}$×100%≈16.7%。B操作是俯视读数,会造成量取的水的体积偏小,导致溶质质量分数偏大;利用量筒读数时,视线应与量筒内凹液面的最低处保持水平。
(3)$t_{2}^{\circ}\text{C}$时,恒温蒸发掉12 g水,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%}}{60\ \text{g-12}\ \text{g}}$×100%=37.5%,A正确;$t_{2}^{\circ}\text{C}$时,恒温蒸发掉原溶液中一半质量的溶剂,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%}}{60\ \text{g-0.5×(60}\ \text{g-60}\ \text{g×30%)}}$×100%≈46%>37.5%,溶液饱和,实际溶液的溶质质量分数为37.5%,B正确;$t_{2}^{\circ}\text{C}$时,加入7.2 g${KNO3}$并搅拌,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%+7.2}\ \text{g}}{60\ \text{g+7.2}\ \text{g}}$×100%=37.5%,C正确;$t_{3}^{\circ}\text{C}$时,加入60 g溶质质量分数为45%的${KNO3}$溶液,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%+60}\ \text{g×45%}}{60\ \text{g+60}\ \text{g}}$×100%=37.5%,D正确。
(1)计算
(2)偏小 16.7 偏大 量筒内凹液面的最低处
(3)ABCD
【解析】
(1)配制溶液的一般步骤是计算、称量、溶解、装瓶存放。
(2)配制50 g溶质质量分数为25%的${KNO3}$溶液,需要${KNO3}$的质量为50 g×25%=12.5 g,需要水的质量为50 g-12.5 g=37.5 g。A操作将砝码与${KNO3}$固体的位置放反了,称量时应将砝码放在右盘,${KNO3}$固体放在左盘,所称量的${KNO3}$固体的质量是10 g-2.5 g=7.5 g,溶质的质量偏小,则导致溶质质量分数偏小;若其他操作都正确,按A操作配制的溶液的溶质质量分数为$\frac{7.5\ \text{g}}{37.5\ \text{g+7.5}\ \text{g}}$×100%≈16.7%。B操作是俯视读数,会造成量取的水的体积偏小,导致溶质质量分数偏大;利用量筒读数时,视线应与量筒内凹液面的最低处保持水平。
(3)$t_{2}^{\circ}\text{C}$时,恒温蒸发掉12 g水,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%}}{60\ \text{g-12}\ \text{g}}$×100%=37.5%,A正确;$t_{2}^{\circ}\text{C}$时,恒温蒸发掉原溶液中一半质量的溶剂,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%}}{60\ \text{g-0.5×(60}\ \text{g-60}\ \text{g×30%)}}$×100%≈46%>37.5%,溶液饱和,实际溶液的溶质质量分数为37.5%,B正确;$t_{2}^{\circ}\text{C}$时,加入7.2 g${KNO3}$并搅拌,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%+7.2}\ \text{g}}{60\ \text{g+7.2}\ \text{g}}$×100%=37.5%,C正确;$t_{3}^{\circ}\text{C}$时,加入60 g溶质质量分数为45%的${KNO3}$溶液,所得溶液的溶质质量分数为$\frac{60\ \text{g×30%+60}\ \text{g×45%}}{60\ \text{g+60}\ \text{g}}$×100%=37.5%,D正确。
查看更多完整答案,请扫码查看


