第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1[2024海南三亚模拟]氮化硅是一种性能优异的无机非金属材料。工业上可采用高纯度硅与氮气在$1300^{\circ }C$条件下反应制备氮化硅,反应原理为$3Si+2N_{2}\xlongequal {1300^{\circ }C}Si_{3}N_{4}$。现需要制备70t的氮化硅,理论上至少需要硅的质量是多少?(写出计算过程)
答案:
解:设理论上至少需要硅的质量为x。
3Si + 2N₂$\frac{\underline{\;1300℃\;}}{}$Si₃N₄
84 140
x 70t
$\frac{84}{140}$=$\frac{x}{70t}$
x = 42t
答:理论上至少需要硅的质量为42t。
[解析]根据Si₃N₄的质量结合化学方程式列式求出Si的质量。
3Si + 2N₂$\frac{\underline{\;1300℃\;}}{}$Si₃N₄
84 140
x 70t
$\frac{84}{140}$=$\frac{x}{70t}$
x = 42t
答:理论上至少需要硅的质量为42t。
[解析]根据Si₃N₄的质量结合化学方程式列式求出Si的质量。
“这里的车棚会发光”——内蒙古党政机关办公区车棚顶安装了5972块光伏板,年发绿电180万度,年减少碳排放1500吨。光伏板的核心材料是单质硅,工业制硅流程中的一步化学方程式为$SiHCl_{3}+H_{2}\xlongequal {1100^{\circ }C}3X+Si$,请回答下列问题。
(1)X的化学式为
(2)请根据化学方程式计算生产56吨Si,需要$H_{2}$多少吨?
解:设生产56吨Si,需要H₂的质量为x。
SiHCl₃ + H₂$\frac{\underline{\;1100℃\;}}{}$3HCl + Si
2 28
x 56吨
$\frac{2}{28}$=$\frac{x}{56吨}$
x = 4吨
答:需要H₂的质量为4吨。
(1)X的化学式为
HCl
。(2)请根据化学方程式计算生产56吨Si,需要$H_{2}$多少吨?
解:设生产56吨Si,需要H₂的质量为x。
SiHCl₃ + H₂$\frac{\underline{\;1100℃\;}}{}$3HCl + Si
2 28
x 56吨
$\frac{2}{28}$=$\frac{x}{56吨}$
x = 4吨
答:需要H₂的质量为4吨。
答案:
(1)HCl
(2)解:设生产56吨Si,需要H₂的质量为x。
SiHCl₃ + H₂$\frac{\underline{\;1100℃\;}}{}$3HCl + Si
2 28
x 56吨
$\frac{2}{28}$=$\frac{x}{56吨}$
x = 4吨
答:需要H₂的质量为4吨。
[解析]
(1)根据质量守恒定律,化学反应前后,原子种类和数目不发生变化,则X的化学式为HCl。
(2)根据Si的质量结合化学方程式列式求出参加反应的氢气的质量。
(1)HCl
(2)解:设生产56吨Si,需要H₂的质量为x。
SiHCl₃ + H₂$\frac{\underline{\;1100℃\;}}{}$3HCl + Si
2 28
x 56吨
$\frac{2}{28}$=$\frac{x}{56吨}$
x = 4吨
答:需要H₂的质量为4吨。
[解析]
(1)根据质量守恒定律,化学反应前后,原子种类和数目不发生变化,则X的化学式为HCl。
(2)根据Si的质量结合化学方程式列式求出参加反应的氢气的质量。
3[2025广东云浮期末,中]化学兴趣小组的同学进行了如图的实验探究。
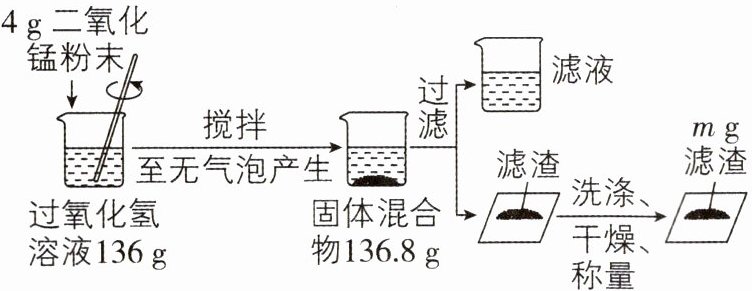
(1)上述实验中,$m= $____,过程中产生的氧气的质量为____g。
(2)计算参加反应的过氧化氢的质量(写出计算过程)。
(3)画出烧杯中水的质量与生成氧气质量之间的关系曲线图,并进行必要的标注。
(4)下列物质均可作为制取氧气的原料。理论上,等质量的下列物质完全分解制得氧气最多的是____(填序号)。
a.$KMnO_{4}$
b.$H_{2}O_{2}$
c.$KClO_{3}$

(1)上述实验中,$m= $____,过程中产生的氧气的质量为____g。
(2)计算参加反应的过氧化氢的质量(写出计算过程)。
(3)画出烧杯中水的质量与生成氧气质量之间的关系曲线图,并进行必要的标注。

(4)下列物质均可作为制取氧气的原料。理论上,等质量的下列物质完全分解制得氧气最多的是____(填序号)。
a.$KMnO_{4}$
b.$H_{2}O_{2}$
c.$KClO_{3}$
答案:
(1)4 3.2
(2)解:设参加反应的过氧化氢的质量为x。
2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O + O₂↑
68 32
x 3.2g
$\frac{68}{32}$=$\frac{x}{3.2g}$
x = 6.8g
答:参加反应的过氧化氢的质量为6.8g。
(3)

(4)b
刷有所得 结合质量守恒定律,推出X的化学式。易错警示催化剂在反应前后质量和化学性质不变。
[解析]
(1)过氧化氢制取氧气的反应中,二氧化锰为催化剂,反应前后质量不变,则m = 4;根据反应前后物质的总质量不变可知,生成氧气的质量为136g + 4g - 136.8g = 3.2g。
(2)根据氧气的质量结合化学方程式列式求出参加反应的过氧化氢的质量。
(3)开始时水的质量为136g - 6.8g = 129.2g,充分反应后水的质量为136.8g - 4g = 132.8g,据此画出烧杯中水的质量与生成氧气质量之间的关系曲线图并进行标注。
(4)由2KMnO₄$\frac{\underline{\;\triangle \;}}{}$K₂MnO₄ + MnO₂ + O₂↑、
316 32
$\frac{2}{3}$KClO₃$\frac{\underline{\;MnO₂\;}}{\triangle }$$\frac{2}{3}$KCl + O₂↑、
81.6 32
2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O + O₂↑可知,生成等质量的氧气,所需物质质量:KMnO₄>KClO₃>H₂O₂,则等质量的三种物质完全分解,过氧化氢生成氧气的质量最多。故选b。
68 32
(1)4 3.2
(2)解:设参加反应的过氧化氢的质量为x。
2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O + O₂↑
68 32
x 3.2g
$\frac{68}{32}$=$\frac{x}{3.2g}$
x = 6.8g
答:参加反应的过氧化氢的质量为6.8g。
(3)

(4)b
刷有所得 结合质量守恒定律,推出X的化学式。易错警示催化剂在反应前后质量和化学性质不变。
[解析]
(1)过氧化氢制取氧气的反应中,二氧化锰为催化剂,反应前后质量不变,则m = 4;根据反应前后物质的总质量不变可知,生成氧气的质量为136g + 4g - 136.8g = 3.2g。
(2)根据氧气的质量结合化学方程式列式求出参加反应的过氧化氢的质量。
(3)开始时水的质量为136g - 6.8g = 129.2g,充分反应后水的质量为136.8g - 4g = 132.8g,据此画出烧杯中水的质量与生成氧气质量之间的关系曲线图并进行标注。
(4)由2KMnO₄$\frac{\underline{\;\triangle \;}}{}$K₂MnO₄ + MnO₂ + O₂↑、
316 32
$\frac{2}{3}$KClO₃$\frac{\underline{\;MnO₂\;}}{\triangle }$$\frac{2}{3}$KCl + O₂↑、
81.6 32
2H₂O₂$\frac{\underline{\;MnO₂\;}}{}$2H₂O + O₂↑可知,生成等质量的氧气,所需物质质量:KMnO₄>KClO₃>H₂O₂,则等质量的三种物质完全分解,过氧化氢生成氧气的质量最多。故选b。
68 32
(1)实验过程中:生成气体质量为
(2)通过计算判断该品牌工业纯碱属于哪一指标等级(写出计算过程,计算结果精确到0.1%)。
解:设样品中碳酸钠的质量为x。
Na₂CO₃ + 2HCl$\xlongequal{\;\;}$2NaCl + H₂O + CO₂↑
106 44
x 8.8g
$\frac{106}{44}$=$\frac{x}{8.8g}$
x = 21.2g
该品牌工业纯碱总碱量为$\frac{21.2g}{21.4g}$×100%≈99.1%。
答:该品牌工业纯碱总碱量为99.1%,属于II类一等品。
8.8g
。(2)通过计算判断该品牌工业纯碱属于哪一指标等级(写出计算过程,计算结果精确到0.1%)。
解:设样品中碳酸钠的质量为x。
Na₂CO₃ + 2HCl$\xlongequal{\;\;}$2NaCl + H₂O + CO₂↑
106 44
x 8.8g
$\frac{106}{44}$=$\frac{x}{8.8g}$
x = 21.2g
该品牌工业纯碱总碱量为$\frac{21.2g}{21.4g}$×100%≈99.1%。
答:该品牌工业纯碱总碱量为99.1%,属于II类一等品。
答案:
(1)8.8g
(2)解:设样品中碳酸钠的质量为x。
Na₂CO₃ + 2HCl$\xlongequal{\;\;}$2NaCl + H₂O + CO₂↑
106 44
x 8.8g
$\frac{106}{44}$=$\frac{x}{8.8g}$
x = 21.2g
该品牌工业纯碱总碱量为$\frac{21.2g}{21.4g}$×100%≈99.1%。
答:该品牌工业纯碱总碱量为99.1%,属于II类一等品。
[解析]
(1)由质量守恒定律可知,生成气体的质量为21.4g + 100g - 112.6g = 8.8g。
(2)根据生成二氧化碳的质量,结合化学方程式列式求出碳酸钠的质量,进而求出工业纯碱中总碱量,判断出该品牌工业纯碱的等级。
(1)8.8g
(2)解:设样品中碳酸钠的质量为x。
Na₂CO₃ + 2HCl$\xlongequal{\;\;}$2NaCl + H₂O + CO₂↑
106 44
x 8.8g
$\frac{106}{44}$=$\frac{x}{8.8g}$
x = 21.2g
该品牌工业纯碱总碱量为$\frac{21.2g}{21.4g}$×100%≈99.1%。
答:该品牌工业纯碱总碱量为99.1%,属于II类一等品。
[解析]
(1)由质量守恒定律可知,生成气体的质量为21.4g + 100g - 112.6g = 8.8g。
(2)根据生成二氧化碳的质量,结合化学方程式列式求出碳酸钠的质量,进而求出工业纯碱中总碱量,判断出该品牌工业纯碱的等级。
查看更多完整答案,请扫码查看


