第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
一、选择题(每题5分,共30分)
1[2024北京中考]下列物质属于纯净物的是 (
A.大理石
B.氯化钾
C.汽水
D.蔗糖溶液
1[2024北京中考]下列物质属于纯净物的是 (
B
)A.大理石
B.氯化钾
C.汽水
D.蔗糖溶液
答案:
B 【解析】大理石含有碳酸钙、氧化钙等,汽水中含有水、碳酸等物质,蔗糖溶液中含有水、蔗糖,都属于混合物;氯化钾中只含有一种物质,属于纯净物。故选 B。
2[2024安徽中考]青藏高原积雪冰川广布,冰雪融水是江河源头的重要补给水源。下列说法正确的是 (
A.水结冰时,水分子不再运动
B.冰融化时,水分子种类发生了变化
C.冰升华时,水分子间的间隔增大
D.冰与水混合得到混合物
C
)A.水结冰时,水分子不再运动
B.冰融化时,水分子种类发生了变化
C.冰升华时,水分子间的间隔增大
D.冰与水混合得到混合物
答案:
C 【解析】分子是不断运动的,水结冰时,水分子仍旧在运动,但运动速率减慢,A 错误;冰融化过程中没有新物质生成,属于物理变化,水分子种类不变,B 错误;冰升华时,水分子间的间隔增大,C 正确;冰与水都是由水分子构成的,混合得到纯净物,D 错误。
3[2024山东青岛中考]现有100g溶质质量分数为10%的葡萄糖溶液,关于此溶液的说法不正确的是 (
A.溶质是葡萄糖,溶剂是水
B.溶质与溶剂的质量比为1:9
C.取出50g此溶液,其溶质质量分数为5%
D.从微观角度看,溶质溶解既有扩散过程,又有水合过程
C
)A.溶质是葡萄糖,溶剂是水
B.溶质与溶剂的质量比为1:9
C.取出50g此溶液,其溶质质量分数为5%
D.从微观角度看,溶质溶解既有扩散过程,又有水合过程
答案:
C 【解析】溶液具有均一性,取出50 g此溶液,其溶质质量分数仍然是10%。故选 C。
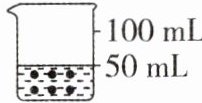
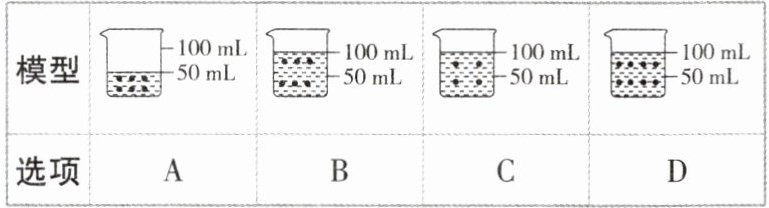
4建立模型是解决问题的一种方法。如图所示烧杯中盛放的是50mL10%的蔗糖溶液,其中“·”表示蔗糖分子。在该溶液中加入一定量的水,使其变为5%的蔗糖溶液。下列能表示稀释后蔗糖溶液模型的是 (
B
)

答案:
B 【解析】将50 mL 10%的蔗糖溶液稀释成5%的蔗糖溶液,根据溶液稀释前后溶质的质量不变,即蔗糖分子数目不变可知,加入水的体积为50 mL,溶液体积为100 mL。故选 B。
5设计并制作净水器。下列说法合理的是 (
6展示并评价作品。下列评价不合理的是 (
C
)6展示并评价作品。下列评价不合理的是 (
A
)
答案:
5. C 【解析】聚氯乙烯塑料中一些有害的化学物质会进入水中,所以用聚氯乙烯塑料制作外壳,不安全环保,A 不符合题意;小卵石和石英砂能够除去水中的难溶性杂质,B 不符合题意;用活性炭净水是因为其结构疏松多孔,有很强的吸附能力,C 符合题意;蓬松棉的主要作用是过滤,除去较小的难溶性颗粒,D 不符合题意。6. A 【解析】该简易净水器不能除去水中的可溶性钙、镁化合物,即不能降低水的硬度。故选 A。
(1)过滤这一步骤是用来除去
(2)标有A的仪器的名称是
(3)图中缺少一种仪器,该仪器的名称是
(4)在净化天然水时,为了促进悬浮杂质的沉降,常在水中加入
(5)若过滤后的水样有颜色,可向滤液中加入活性炭,该过程发生的是
(6)再用滴管取2滴过滤后的滤液滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是
难溶
的固体杂质的。(2)标有A的仪器的名称是
漏斗
。(3)图中缺少一种仪器,该仪器的名称是
玻璃棒
,其作用是引流
。(4)在净化天然水时,为了促进悬浮杂质的沉降,常在水中加入
明矾
。(5)若过滤后的水样有颜色,可向滤液中加入活性炭,该过程发生的是
物理
变化。(6)再用滴管取2滴过滤后的滤液滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是
水中溶解有其他物质
。
答案:
(1)难溶
(2)漏斗
(3)玻璃棒 引流
(4)明矾
(5)物理
(6)水中溶解有其他物质 【解析】
(1)过滤这一步骤是用来除去难溶的固体杂质的。
(2)标有A的仪器的名称是漏斗。
(3)图中缺少的仪器的名称是玻璃棒,其作用是引流。
(4)在净化天然水时,为了促进悬浮杂质的沉降,常在水中加入明矾。
(5)若过滤后的水样有颜色,可向滤液中加入活性炭,利用其吸附性去除颜色,该过程发生的是物理变化。
(6)再用滴管取2滴过滤后的滤液滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是水中溶解有其他物质。
(1)难溶
(2)漏斗
(3)玻璃棒 引流
(4)明矾
(5)物理
(6)水中溶解有其他物质 【解析】
(1)过滤这一步骤是用来除去难溶的固体杂质的。
(2)标有A的仪器的名称是漏斗。
(3)图中缺少的仪器的名称是玻璃棒,其作用是引流。
(4)在净化天然水时,为了促进悬浮杂质的沉降,常在水中加入明矾。
(5)若过滤后的水样有颜色,可向滤液中加入活性炭,利用其吸附性去除颜色,该过程发生的是物理变化。
(6)再用滴管取2滴过滤后的滤液滴在洁净的玻璃片上,置于酒精灯上小心加热,水分消失后,观察到玻璃片上有少许固体残留物,产生该现象的原因是水中溶解有其他物质。
(1)若配制50g溶质质量分数为6%的氯化钠溶液,所需氯化钠和水的质量为氯化钠
(2)完成此实验正确的操作顺序是
(3)图甲中仪器a的名称是
(4)小婧按图乙的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是
(5)下列因素会造成所配溶液溶质质量分数偏小的是
(6)某同学选用溶质质量分数为12%的氯化钠溶液,将其稀释制成50g溶质质量分数6%的氯化钠溶液。
①所需浓氯化钠溶液的质量为
②经测定,配制成的氯化钠溶液的溶质质量分数大于6%,其原因可能是
3
g,水47
g。(2)完成此实验正确的操作顺序是
④③①②
(填序号)。(3)图甲中仪器a的名称是
烧杯
,图甲中还缺少的玻璃仪器是玻璃棒
(填名称)。(4)小婧按图乙的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是
试剂和砝码放反了
。(5)下列因素会造成所配溶液溶质质量分数偏小的是
AC
(填序号)。(6)某同学选用溶质质量分数为12%的氯化钠溶液,将其稀释制成50g溶质质量分数6%的氯化钠溶液。
①所需浓氯化钠溶液的质量为
25
g,还需加入水的质量为25
g。②经测定,配制成的氯化钠溶液的溶质质量分数大于6%,其原因可能是
量取12%的氯化钠溶液的体积时,仰视读数
(填一条)。
答案:
(1)3 47
(2)④③①②
(3)烧杯 玻璃棒
(4)试剂和砝码放反了,在称量纸上称量有腐蚀性的NaOH
(5)AC
(6)①25 25 ②量取12%的氯化钠溶液的体积时,仰视读数(合理即可) 【解析】
(1)配制50 g溶质质量分数为6%的氯化钠溶液时,需要氯化钠的质量为$50\;\mathrm{g}× 6\%=3\;\mathrm{g}$,水的质量为$50\;\mathrm{g}-3\;\mathrm{g}=47\;\mathrm{g}$。
(2)配制一定溶质质量分数的溶液的步骤为计算、称量和量取、溶解、装瓶存放,则顺序为④③①②。
(3)由图甲可知,仪器a的名称是烧杯;配制一定溶质质量分数的溶液时,需要的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,则还缺少药匙和玻璃棒,其中玻璃棒为玻璃仪器。
(4)用托盘天平称量时,应左物右码,图乙中操作的错误是试剂和砝码放反了,在称量纸上称量有腐蚀性的NaOH。
(5)量取蒸馏水时仰视读数,则实际量取的水的体积偏大,溶质质量分数会偏小,故A选项符合题意;量取蒸馏水时俯视读数,则实际量取的水的体积偏小,溶质质量分数会偏大,故B选项不符合题意;若称量好的氯化钠洒落,则溶质质量偏小,溶质质量分数会偏小,故C选项符合题意;溶液具有均一性、稳定性,配好的溶液洒出不会影响溶质量分数,故D选项不符合题意。
(6)①设所需浓氯化钠溶液的质量为x,$x× 12\%=50\;\mathrm{g}× 6\%$,$x=25\;\mathrm{g}$,所需浓氯化钠溶液的质量为25 g。加水的质量为$50\;\mathrm{g}-25\;\mathrm{g}=25\;\mathrm{g}$。②配制成的NaCl溶液的溶质质量分数大于6%,可能的原因是量取12%的氯化钠溶液的体积时仰视读数或量取水的体积时俯视读数等。
(1)3 47
(2)④③①②
(3)烧杯 玻璃棒
(4)试剂和砝码放反了,在称量纸上称量有腐蚀性的NaOH
(5)AC
(6)①25 25 ②量取12%的氯化钠溶液的体积时,仰视读数(合理即可) 【解析】
(1)配制50 g溶质质量分数为6%的氯化钠溶液时,需要氯化钠的质量为$50\;\mathrm{g}× 6\%=3\;\mathrm{g}$,水的质量为$50\;\mathrm{g}-3\;\mathrm{g}=47\;\mathrm{g}$。
(2)配制一定溶质质量分数的溶液的步骤为计算、称量和量取、溶解、装瓶存放,则顺序为④③①②。
(3)由图甲可知,仪器a的名称是烧杯;配制一定溶质质量分数的溶液时,需要的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,则还缺少药匙和玻璃棒,其中玻璃棒为玻璃仪器。
(4)用托盘天平称量时,应左物右码,图乙中操作的错误是试剂和砝码放反了,在称量纸上称量有腐蚀性的NaOH。
(5)量取蒸馏水时仰视读数,则实际量取的水的体积偏大,溶质质量分数会偏小,故A选项符合题意;量取蒸馏水时俯视读数,则实际量取的水的体积偏小,溶质质量分数会偏大,故B选项不符合题意;若称量好的氯化钠洒落,则溶质质量偏小,溶质质量分数会偏小,故C选项符合题意;溶液具有均一性、稳定性,配好的溶液洒出不会影响溶质量分数,故D选项不符合题意。
(6)①设所需浓氯化钠溶液的质量为x,$x× 12\%=50\;\mathrm{g}× 6\%$,$x=25\;\mathrm{g}$,所需浓氯化钠溶液的质量为25 g。加水的质量为$50\;\mathrm{g}-25\;\mathrm{g}=25\;\mathrm{g}$。②配制成的NaCl溶液的溶质质量分数大于6%,可能的原因是量取12%的氯化钠溶液的体积时仰视读数或量取水的体积时俯视读数等。
查看更多完整答案,请扫码查看


