第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
1 [2024山东青岛中考]科学家运用了模型建构的方法探索原子的结构。下列对原子结构模型演变过程的认识,不正确的是(
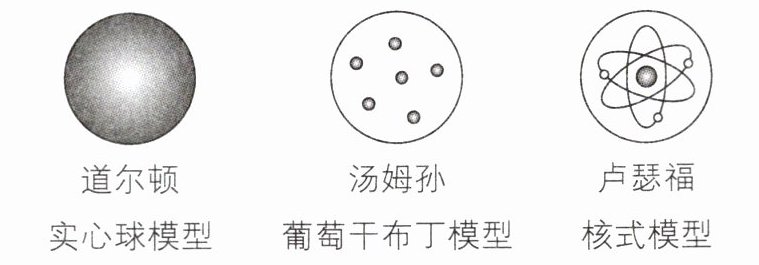
A.道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
B.汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C.卢瑟福等人通过α粒子散射实验修正了汤姆孙葡萄干布丁模型
D.卢瑟福核式模型是最完善的原子结构模型,不会被替代
D
)
A.道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
B.汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C.卢瑟福等人通过α粒子散射实验修正了汤姆孙葡萄干布丁模型
D.卢瑟福核式模型是最完善的原子结构模型,不会被替代
答案:
1.D 【解析】卢瑟福的核式模型不一定是最完善的原子结构模型,随着科学的发展,人们逐渐认识到原子核内部还有更复杂的结构,如夸克等。故选D。
2 [2024辽宁中考]高纯硼常用作半导体掺杂剂。硼原子的结构示意图如图所示,下列说法正确的是(

A.图中x为2
B.硼原子的核外电子带正电
C.硼原子的质子数为3
D.硼元素的相对原子质量为5g
A
)
A.图中x为2
B.硼原子的核外电子带正电
C.硼原子的质子数为3
D.硼元素的相对原子质量为5g
答案:
2.A 【解析】根据原子核外电子排布规律,第一层最多容纳2个电子,则x=2,A正确;核外电子带负电,B错误;原子结构示意图中,圆圈内数字表示该原子的质子数,则硼原子的质子数为5,C错误;根据题中所给的条件无法计算相对原子质量,且相对原子质量的单位为“1”,不是“g”,一般省略不写,D错误。
如图是镁元素在元素周期表中的部分信息。下列说法错误的是(
A.镁原子核外有12个电子
B.该元素属于金属元素
C.镁原子核内有12个质子
D.镁的相对原子质量是24.31g
D
)A.镁原子核外有12个电子
B.该元素属于金属元素
C.镁原子核内有12个质子
D.镁的相对原子质量是24.31g
答案:
3.D 【解析】相对原子质量的单位是“1”,通常省略不写,镁的相对原子质量为24.31,D错误。
4 [2024山东济宁中考]如图是元素周期表的一部分,表中的数字编号①和②各表示一种元素。
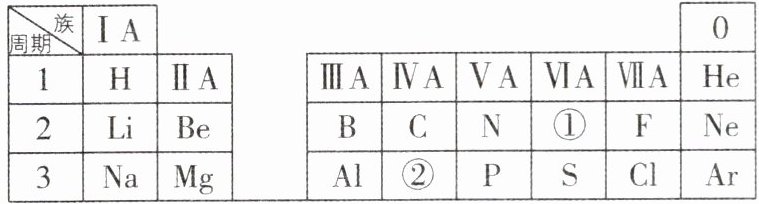
请回答。
(1)①所表示元素的质子数为______;
(2)②表示硅元素,晶体硅广泛应用于芯片、太阳能光伏板的生产中,给人类的生活带来了便利,请画出硅元素的原子结构示意图:______;硅酸钠(化学式为$Na_2SiO_3)$水溶液俗称水玻璃,有很强的防腐功能,硅酸钠中硅元素的化合价是______;
(3)元素F和Cl化学性质相似,原因是______。

请回答。
(1)①所表示元素的质子数为______;
(2)②表示硅元素,晶体硅广泛应用于芯片、太阳能光伏板的生产中,给人类的生活带来了便利,请画出硅元素的原子结构示意图:______;硅酸钠(化学式为$Na_2SiO_3)$水溶液俗称水玻璃,有很强的防腐功能,硅酸钠中硅元素的化合价是______;
(3)元素F和Cl化学性质相似,原因是______。
答案:
4.
(1)8
(2) +14 2 8 4 +4
+14 2 8 4 +4
(3)原子的最外层电子数相同
【解析】
(1)元素周期表是按原子序数递增的顺序排列的,故①所表示元素的质子数为8。
(2)硅元素的原子序数为14,原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数均为14,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,最外层上有4个电子,其原子结构示意图为 。硅酸钠中钠元素显+1价,氧元素显 - 2价,设硅元素的化合价是x,根据在化合物中各元素正负化合价代数和为零,可得(+1)×2+x+( - 2)×3=0,则x=+4。
。硅酸钠中钠元素显+1价,氧元素显 - 2价,设硅元素的化合价是x,根据在化合物中各元素正负化合价代数和为零,可得(+1)×2+x+( - 2)×3=0,则x=+4。
(3)元素F和Cl化学性质相似,原因是原子的最外层电子数相同。
易错警示
确定元素时,一定要注意微粒的结构示意图是否为原子的结构示意图。
关键点拨
决定元素化学性质的重要依据是原子的最外层电子数,元素周期表中同一族元素原子的最外层电子数相同(除He外)。
4.
(1)8
(2)
 +14 2 8 4 +4
+14 2 8 4 +4 (3)原子的最外层电子数相同
【解析】
(1)元素周期表是按原子序数递增的顺序排列的,故①所表示元素的质子数为8。
(2)硅元素的原子序数为14,原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数均为14,核外有3个电子层,第一层上有2个电子,第二层上有8个电子,最外层上有4个电子,其原子结构示意图为
 。硅酸钠中钠元素显+1价,氧元素显 - 2价,设硅元素的化合价是x,根据在化合物中各元素正负化合价代数和为零,可得(+1)×2+x+( - 2)×3=0,则x=+4。
。硅酸钠中钠元素显+1价,氧元素显 - 2价,设硅元素的化合价是x,根据在化合物中各元素正负化合价代数和为零,可得(+1)×2+x+( - 2)×3=0,则x=+4。(3)元素F和Cl化学性质相似,原因是原子的最外层电子数相同。
易错警示
确定元素时,一定要注意微粒的结构示意图是否为原子的结构示意图。
关键点拨
决定元素化学性质的重要依据是原子的最外层电子数,元素周期表中同一族元素原子的最外层电子数相同(除He外)。
“临沂炒鸡”是临沂一张靓丽的美食名片,其特点是麻辣鲜香。“麻”的灵魂源于花椒中的花椒酰胺(C₁₆H₂₅NO),下列有关花椒酰胺的说法中错误的是(
A.1个花椒酰胺分子由43个原子构成
B.花椒酰胺的相对分子质量为247
C.花椒酰胺中碳、氧元素的质量比为16:1
D.247g花椒酰胺中含氮元素的质量为14g
C
)A.1个花椒酰胺分子由43个原子构成
B.花椒酰胺的相对分子质量为247
C.花椒酰胺中碳、氧元素的质量比为16:1
D.247g花椒酰胺中含氮元素的质量为14g
答案:
5.C 【解析】1个花椒酰胺分子是由16个碳原子、25个氢原子、1个氮原子和1个氧原子构成的,则1个花椒酰胺分子由43个原子构成,A正确;花椒酰胺的相对分子质量为12×16+1×25+14+16=247,B正确;花椒酰胺中碳、氧元素的质量比为(12×16):(16×1)=12:1,C错误;247g花椒酰胺中含氮元素的质量为247g×(14/247×100%)=14g,D正确。
6 [2024山东济宁中考,中]菠萝具有特殊的果香,是由于菠萝中含有的丁酸乙酯[化学式为$C_6H_1_2O_2,$结构简式为$CH_3(CH_2)_2COOC_2H_5]$发出的芳香气味。请回答。
(1)丁酸乙酯分子中,C、H、O三种原子的个数比为______
(2)丁酸乙酯中,C、H、O三种元素的质量比为______
(1)丁酸乙酯分子中,C、H、O三种原子的个数比为______
3:6:1
。(2)丁酸乙酯中,C、H、O三种元素的质量比为______
18:3:8
。
答案:
6.
(1)3:6:1
(2)18:3:8
【解析】
(1)1个丁酸乙酯分子是由6个碳原子、12个氢原子、2个氧原子构成的,则丁酸乙酯分子中,C、H、O三种原子的个数比为6:12:2=3:6:1。
(2)丁酸乙酯中,C、H、O三种元素的质量比为(12×6):(1×12):(16×2)=18:3:8。
(1)3:6:1
(2)18:3:8
【解析】
(1)1个丁酸乙酯分子是由6个碳原子、12个氢原子、2个氧原子构成的,则丁酸乙酯分子中,C、H、O三种原子的个数比为6:12:2=3:6:1。
(2)丁酸乙酯中,C、H、O三种元素的质量比为(12×6):(1×12):(16×2)=18:3:8。
查看更多完整答案,请扫码查看


