2025年奔跑吧少年九年级科学全一册浙教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年奔跑吧少年九年级科学全一册浙教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第16页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
例3 (2023秋·台州市黄岩区期末)实验室用金属镁与稀盐酸反应来探究酸的性质。小黄取反应后的溶液100克,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液质量的关系如图所示。已知当NaOH溶液滴加至150克时不再有沉淀产生。
(1)求c点时所产生的沉淀质量。
(2)若在b点时加$AgNO_3$溶液后出现白色沉淀,则______
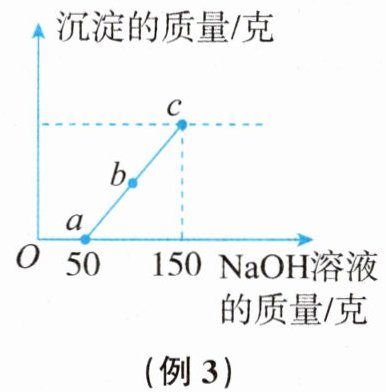
(1)求c点时所产生的沉淀质量。
5.8克
(2)若在b点时加$AgNO_3$溶液后出现白色沉淀,则______
不能
(填“能”或“不能”)证明稀盐酸有剩余。
答案:
(1)设c点时所产生的沉淀质量为x。
2NaOH + MgCl₂ = 2NaCl + Mg(OH)₂↓
80 58
(150克−50克)×8% x
$\frac{80}{58}$ = $\frac{(150克 - 50克)×8\%}{x}$ x = 5.8克
(2)不能
(1)设c点时所产生的沉淀质量为x。
2NaOH + MgCl₂ = 2NaCl + Mg(OH)₂↓
80 58
(150克−50克)×8% x
$\frac{80}{58}$ = $\frac{(150克 - 50克)×8\%}{x}$ x = 5.8克
(2)不能
跟踪训练3-1 已知赤铁矿石的主要成分为氧化铁。某课外兴趣小组的同学将18克赤铁矿石样品(杂质既不溶于水,也不参加反应)放入烧杯中,并不断加入稀盐酸,烧杯中固体的质量随加入稀盐酸的质量变化情况如图所示。
(1)该赤铁矿石样品中氧化铁的质量为______
(2)计算加入稀盐酸至恰好完全反应时所得溶液的溶质质量分数(写出计算过程)。
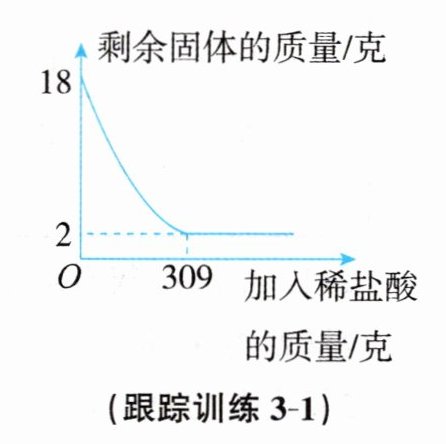
解:设生成的氯化铁质量为x。
Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
160 325
16 x
$\frac{160}{325}$ = $\frac{16}{x}$ x = 32.5克
则所得溶液的质量分数为$\frac{32.5克}{309克 + 16克}$×100% = 10%。
答:所得溶液的溶质质量分数为10%。
(1)该赤铁矿石样品中氧化铁的质量为______
16
克。(2)计算加入稀盐酸至恰好完全反应时所得溶液的溶质质量分数(写出计算过程)。

解:设生成的氯化铁质量为x。
Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
160 325
16 x
$\frac{160}{325}$ = $\frac{16}{x}$ x = 32.5克
则所得溶液的质量分数为$\frac{32.5克}{309克 + 16克}$×100% = 10%。
答:所得溶液的溶质质量分数为10%。
答案:
(1)16
(2)设生成的氯化铁质量为x。
Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
160 325
16 x
$\frac{160}{325}$ = $\frac{16}{x}$ x = 32.5克
则所得溶液的质量分数为$\frac{32.5克}{309克 + 16克}$×100% = 10%。
(1)16
(2)设生成的氯化铁质量为x。
Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
160 325
16 x
$\frac{160}{325}$ = $\frac{16}{x}$ x = 32.5克
则所得溶液的质量分数为$\frac{32.5克}{309克 + 16克}$×100% = 10%。
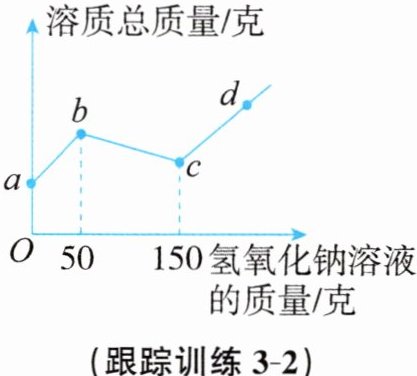
跟踪训练3-2 (2024秋·湖州市长兴县期末)往100克硫酸和硫酸铜的混合液中,逐滴加入8%的氢氧化钠溶液直至过量,根据实验事实绘制了如图所示的曲线。
(1)a→b段表示氢氧化钠与混合物中的______
(2)c点时溶液中的溶质是______
(3)求反应前混合液中硫酸铜的溶质质量分数。
(1)a→b段表示氢氧化钠与混合物中的______
硫酸
发生反应。(2)c点时溶液中的溶质是______
硫酸钠
。(3)求反应前混合液中硫酸铜的溶质质量分数。

答案:
(1)硫酸
(2)硫酸钠
(3)与硫酸铜反应的氢氧化钠的质量为(150克−50克)×8% = 8克,设反应前混合液中硫酸铜的质量分数为x。
2NaOH + CuSO₄ = Na₂SO₄ + Cu(OH)₂↓
80 160
8克 100克×x
$\frac{160}{100克×x}$ = $\frac{80}{8克}$ x = 16%。
(1)硫酸
(2)硫酸钠
(3)与硫酸铜反应的氢氧化钠的质量为(150克−50克)×8% = 8克,设反应前混合液中硫酸铜的质量分数为x。
2NaOH + CuSO₄ = Na₂SO₄ + Cu(OH)₂↓
80 160
8克 100克×x
$\frac{160}{100克×x}$ = $\frac{80}{8克}$ x = 16%。
查看更多完整答案,请扫码查看


