2025年奔跑吧少年九年级科学全一册浙教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年奔跑吧少年九年级科学全一册浙教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第14页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
例1 (2024秋·金华市期末)
工业纯碱中常含有少量的氯化钠,某小组同学对其组成展开探究。现取14克纯碱样品,加入100克水使其完全溶解,再加入96克过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀10克。
(1)反应后溶液中含有的溶质是______
(2)计算反应后溶液中氯化钠的质量分数。根据质量守恒定律可得,反应后溶液的质量为14克+100克+96克−10克=200克,设样品中碳酸钠的质量为x,生成的氯化钠的质量为y。
CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
106 100 117
x 10克 y
$\frac{106}{x}$ = $\frac{117}{y}$ = $\frac{100}{10克}$ x = 10.6克,y = 11.7克
反应后溶液中氯化钠的质量分数为$\frac{14克 - 10.6克 + 11.7克}{200克}$×100% = 7.55%。
工业纯碱中常含有少量的氯化钠,某小组同学对其组成展开探究。现取14克纯碱样品,加入100克水使其完全溶解,再加入96克过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀10克。
(1)反应后溶液中含有的溶质是______
CaCl₂、NaCl
(填化学式)。(2)计算反应后溶液中氯化钠的质量分数。根据质量守恒定律可得,反应后溶液的质量为14克+100克+96克−10克=200克,设样品中碳酸钠的质量为x,生成的氯化钠的质量为y。
CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
106 100 117
x 10克 y
$\frac{106}{x}$ = $\frac{117}{y}$ = $\frac{100}{10克}$ x = 10.6克,y = 11.7克
反应后溶液中氯化钠的质量分数为$\frac{14克 - 10.6克 + 11.7克}{200克}$×100% = 7.55%。
答案:
(1)CaCl₂、NaCl
(2)根据质量守恒定律可得,反应后溶液的质量为14克+100克+96克−10克=200克,设样品中碳酸钠的质量为x,生成的氯化钠的质量为y。
CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
106 100 117
x 10克 y
$\frac{106}{x}$ = $\frac{117}{y}$ = $\frac{100}{10克}$ x = 10.6克,y = 11.7克
反应后溶液中氯化钠的质量分数为$\frac{14克 - 10.6克 + 11.7克}{200克}$×100% = 7.55%。
(1)CaCl₂、NaCl
(2)根据质量守恒定律可得,反应后溶液的质量为14克+100克+96克−10克=200克,设样品中碳酸钠的质量为x,生成的氯化钠的质量为y。
CaCl₂ + Na₂CO₃ = CaCO₃↓ + 2NaCl
106 100 117
x 10克 y
$\frac{106}{x}$ = $\frac{117}{y}$ = $\frac{100}{10克}$ x = 10.6克,y = 11.7克
反应后溶液中氯化钠的质量分数为$\frac{14克 - 10.6克 + 11.7克}{200克}$×100% = 7.55%。
跟踪训练1-1 某补钙剂(有效成分为碳酸钙,其他成分中不含钙元素)的说明中标明含钙量为30%。小李为了检验该产品,取10克补钙剂放入100克稀盐酸中,刚好完全反应(其他成分不与盐酸反应),反应后剩余固体和液体的总质量比反应前减少了2.2克。求:
(1)所用稀盐酸的溶质质量分数。
(2)所得溶液的溶质质量分数。(结果精确到0.1%)
(1)所用稀盐酸的溶质质量分数。
(2)所得溶液的溶质质量分数。(结果精确到0.1%)
答案:
(1)设所用稀盐酸的溶质质量分数为x,生成的氯化钙的质量为y,消耗的碳酸钙的质量为z。
CaCO₃ + 2HCl = H₂O + CaCl₂ + CO₂↑
100 73 111 44
z 100克×x y 2.2克
$\frac{73}{100克×x}$ = $\frac{111}{y}$ = $\frac{44}{2.2克}$ = $\frac{100}{z}$ x = 3.65%,y = 5.55克,z = 5克
(2)所得溶液的溶质质量分数为$\frac{5.55克}{5克 + 100克 - 2.2克}$×100% ≈ 5.4%。
(1)设所用稀盐酸的溶质质量分数为x,生成的氯化钙的质量为y,消耗的碳酸钙的质量为z。
CaCO₃ + 2HCl = H₂O + CaCl₂ + CO₂↑
100 73 111 44
z 100克×x y 2.2克
$\frac{73}{100克×x}$ = $\frac{111}{y}$ = $\frac{44}{2.2克}$ = $\frac{100}{z}$ x = 3.65%,y = 5.55克,z = 5克
(2)所得溶液的溶质质量分数为$\frac{5.55克}{5克 + 100克 - 2.2克}$×100% ≈ 5.4%。
跟踪训练1-2 为测定某盐酸中溶质的质量分数,小科取该盐酸样品50克,向其中加入过量锌粒,完全反应后收集到0.3克氢气。
(1)求该盐酸中溶质的质量分数。
(2)小科将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸的溶质质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测量值不符(实验过程无误),你认为其原因可能是______
(1)求该盐酸中溶质的质量分数。
设该盐酸中溶质的质量为x,则
2HCl + Zn = ZnCl₂ + H₂↑
73 2
x 0.3克
$\frac{73}{x}$ = $\frac{2}{0.3克}$ x = 10.95克
所以盐酸的质量分数为$\frac{10.95克}{50克}$×100% = 21.9%。
2HCl + Zn = ZnCl₂ + H₂↑
73 2
x 0.3克
$\frac{73}{x}$ = $\frac{2}{0.3克}$ x = 10.95克
所以盐酸的质量分数为$\frac{10.95克}{50克}$×100% = 21.9%。
(2)小科将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸的溶质质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测量值不符(实验过程无误),你认为其原因可能是______
浓盐酸具有挥发性
。
答案:
(1)设该盐酸中溶质的质量为x,则
2HCl + Zn = ZnCl₂ + H₂↑
73 2
x 0.3克
$\frac{73}{x}$ = $\frac{2}{0.3克}$ x = 10.95克
所以盐酸的质量分数为$\frac{10.95克}{50克}$×100% = 21.9%。
(2)浓盐酸具有挥发性
(1)设该盐酸中溶质的质量为x,则
2HCl + Zn = ZnCl₂ + H₂↑
73 2
x 0.3克
$\frac{73}{x}$ = $\frac{2}{0.3克}$ x = 10.95克
所以盐酸的质量分数为$\frac{10.95克}{50克}$×100% = 21.9%。
(2)浓盐酸具有挥发性
例2 (2024秋·绍兴市期末)小明想测定某石灰石样品中碳酸钙的质量分数。他先将10克样品放入锥形瓶中,再逐滴加入稀盐酸充分反应。反应过程中测得滴加稀盐酸的总质量与充分反应后锥形瓶内剩余物质总质量的数据如表所示。(该石灰石中杂质不溶于水,也不与酸反应)
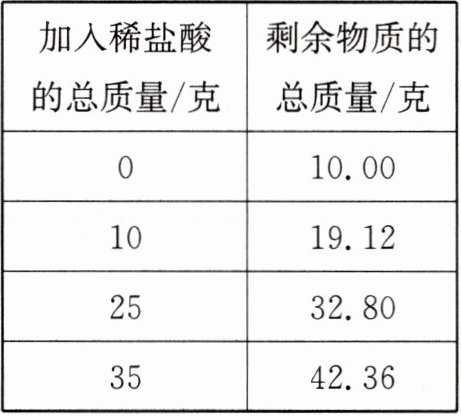
(1)10克该石灰石样品与稀盐酸恰好完全反应时,产生二氧化碳的总质量是
(2)该样品中碳酸钙的质量分数为多少?
(3)这种测定方法产生误差的原因可能是

(1)10克该石灰石样品与稀盐酸恰好完全反应时,产生二氧化碳的总质量是
2.64
克,消耗的稀盐酸的总质量是30
克。(2)该样品中碳酸钙的质量分数为多少?
(3)这种测定方法产生误差的原因可能是
有少量二氧化碳溶于水(合理均可)
(写出一条)。
答案:
(1)2.64 30
(2)设该样品中碳酸钙的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 44
x 2.64克
$\frac{100}{x}$ = $\frac{44}{2.64克}$ x = 6克
则样品中碳酸钙的质量分数为$\frac{6}{10克}$×100% = 60%。
(3)有少量二氧化碳溶于水(合理均可)
(1)2.64 30
(2)设该样品中碳酸钙的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 44
x 2.64克
$\frac{100}{x}$ = $\frac{44}{2.64克}$ x = 6克
则样品中碳酸钙的质量分数为$\frac{6}{10克}$×100% = 60%。
(3)有少量二氧化碳溶于水(合理均可)
跟踪训练2-1 (2024秋·宁波市北仑区期末)“低钠盐”是在精盐中加入适量的食用氯化钾,以降低食盐中钠元素的含量。生产厂家为改善“低钠盐”的味道,会向其中添加少量食用硫酸镁。
(1)小科欲测定“低钠盐”中硫酸镁的质量分数:取40克样品于烧杯中,加入适量蒸馏水使其完全溶解;将100克10%氯化钡溶液分五次加入烧杯中,生成的沉淀经过洗涤、过滤、烘干后称量,沉淀质量如表所示(“低钠盐”中其他成分都能溶于水且不参与反应)。
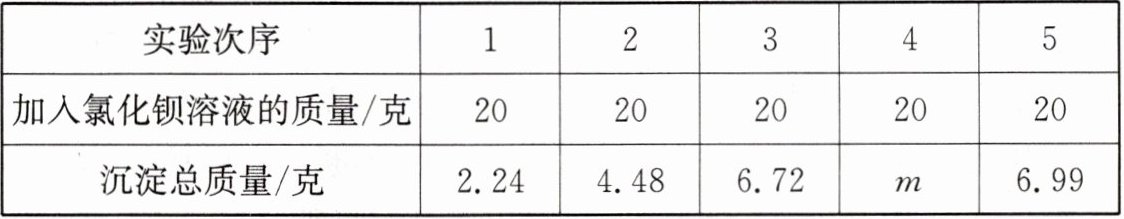
①表中m的值为______
②样品中硫酸镁的质量分数为多少?
(2)测量后,小科反思:第5次实验后,如果未将沉淀洗涤干净,会使测量结果偏大。要判断沉淀是否洗涤干净,下列试剂中,可用来检验的是(
$A. NaNO_3$
$B. Na_2CO_3$
$C. AgNO_3$
$D. Na_2SO_4$
(1)小科欲测定“低钠盐”中硫酸镁的质量分数:取40克样品于烧杯中,加入适量蒸馏水使其完全溶解;将100克10%氯化钡溶液分五次加入烧杯中,生成的沉淀经过洗涤、过滤、烘干后称量,沉淀质量如表所示(“低钠盐”中其他成分都能溶于水且不参与反应)。

①表中m的值为______
6.99
。②样品中硫酸镁的质量分数为多少?
(2)测量后,小科反思:第5次实验后,如果未将沉淀洗涤干净,会使测量结果偏大。要判断沉淀是否洗涤干净,下列试剂中,可用来检验的是(
BCD
)(多选,填字母)。$A. NaNO_3$
$B. Na_2CO_3$
$C. AgNO_3$
$D. Na_2SO_4$
答案:
(1)①6.99 ②由表中数据可知,生成硫酸钡的总质量为6.99克,设40克样品中硫酸镁的质量为x。
BaCl₂ + MgSO₄ = BaSO₄↓ + MgCl₂
120 233
x 6.99克
$\frac{120}{233}$ = $\frac{x}{6.99克}$ x = 3.6克
则样品中硫酸镁的质量分数为$\frac{3.6克}{40克}$×100% = 9%。
(2)BCD
(1)①6.99 ②由表中数据可知,生成硫酸钡的总质量为6.99克,设40克样品中硫酸镁的质量为x。
BaCl₂ + MgSO₄ = BaSO₄↓ + MgCl₂
120 233
x 6.99克
$\frac{120}{233}$ = $\frac{x}{6.99克}$ x = 3.6克
则样品中硫酸镁的质量分数为$\frac{3.6克}{40克}$×100% = 9%。
(2)BCD
查看更多完整答案,请扫码查看


