2025年奔跑吧少年九年级科学全一册浙教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年奔跑吧少年九年级科学全一册浙教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 酸碱指示剂:在酸或碱溶液里能显示出不同颜色的物质,常见的有
紫色石蕊
试液(酸红碱蓝)和无色酚酞
试液(酸无色,碱红色)。
答案:
紫色石蕊 无色酚酞
2. pH:溶液酸碱性强弱程度(酸碱度)的表示方法,取值范围通常为
0~14
。pH>
7,溶液呈碱性;pH=
7,溶液呈中性;pH<
7,溶液呈酸性。
答案:
0~14 > = <
1. 几种常见的酸。
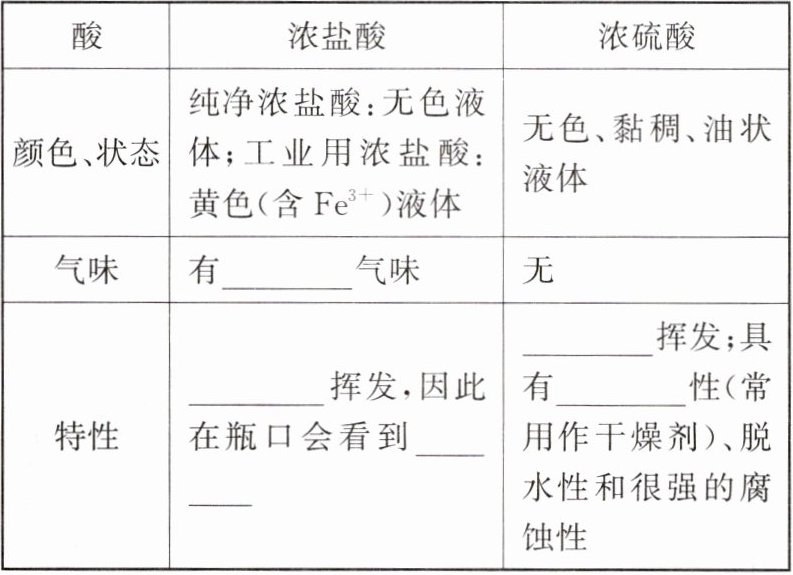
第三行:

第三行:
刺激性
第四行:易
白雾
不易
吸水
答案:
第三行:刺激性 第四行:易 白雾 不易 吸水
2. 酸的共性:在水溶液中电离出的阳离子全部是
(1)与指示剂的显色反应:酸能使紫色石蕊试液变
(2)与活泼金属反应产生氢气,如$:Fe+2HCl= $
(3)与某些金属氧化物反应,可用于金属除锈,如$:$
(4)与碱发生反应,如:NaOH+HCl= NaCl+
(5)与某些盐反应,如$:$
H⁺
。(1)与指示剂的显色反应:酸能使紫色石蕊试液变
红
色,不能使无色酚酞试液变色。(2)与活泼金属反应产生氢气,如$:Fe+2HCl= $
FeCl₂
$+H_2↑。$(3)与某些金属氧化物反应,可用于金属除锈,如$:$
Fe₂O₃
$+6HCl= 2FeCl_3+3H_2O。$(4)与碱发生反应,如:NaOH+HCl= NaCl+
H₂O
。(5)与某些盐反应,如$:$
CaCO₃
$+2HCl= CaCl_2+H_2O+CO_2↑。$
答案:
H⁺
(1)红
(2)FeCl₂
(3)Fe₂O₃
(4)H₂O
(5)CaCO₃
(1)红
(2)FeCl₂
(3)Fe₂O₃
(4)H₂O
(5)CaCO₃
3. 酸的个性。
$AgNO_3+HCl= $
$Ba(NO_3)_2+H_2SO_4= $
$AgNO_3+HCl= $
AgCl↓
$+HNO_3($检验Cl⁻)$Ba(NO_3)_2+H_2SO_4= $
BaSO₄↓
$+2HNO_3($检验$SO_4^2⁻)$
答案:
AgCl↓ BaSO₄↓
1. 常见的碱。

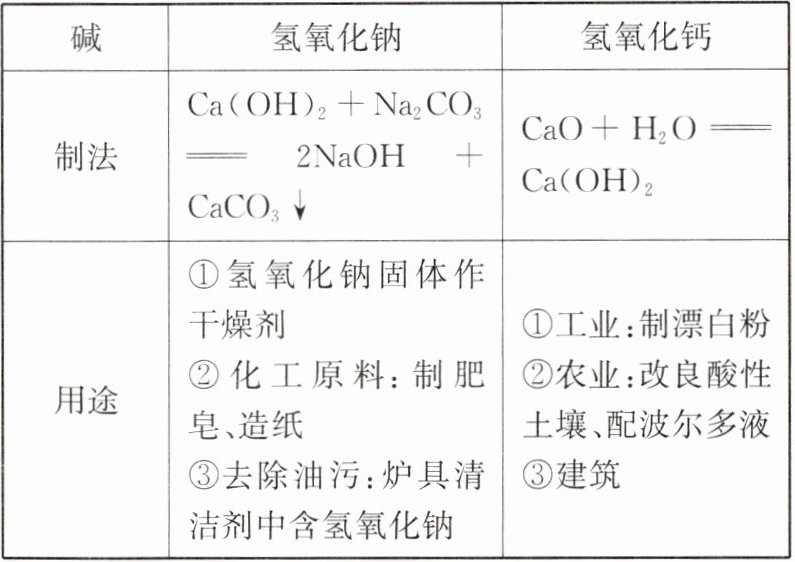
第二行:


第二行:
极易
微
第三行:烧碱
答案:
第二行:极易 微 第三行:烧碱
2. 碱的共性:在水溶液中电离出的阴离子全部是
(1)可溶性碱都能使紫色石蕊试液变
(2)与某些非金属氧化物反应,如:
$2NaOH+SO_2=$
$Ca(OH)_2+CO_2=$
(3)与酸发生中和反应
(4)与某些可溶性盐发生复分解反应,如:
$CuSO_4+2NaOH= Na_2SO_4+$
OH⁻
。(1)可溶性碱都能使紫色石蕊试液变
蓝
,使无色酚酞试液变红
。(2)与某些非金属氧化物反应,如:
$2NaOH+SO_2=$
Na₂SO₃
$+H_2O($应用:工业上常用碱溶液来吸收$SO_2$气体)$Ca(OH)_2+CO_2=$
CaCO₃↓
$+H_2O($应用:澄清石灰水可用于检验$CO_2$气体)(3)与酸发生中和反应
(4)与某些可溶性盐发生复分解反应,如:
$CuSO_4+2NaOH= Na_2SO_4+$
Cu(OH)₂↓
($现象:产生蓝色絮状沉淀)$FeCl_3+3NaOH= 3NaCl+$Fe(OH)₃↓
($现象:产生红褐色絮状沉淀)
答案:
OH⁻
(1)蓝 红
(2)Na₂SO₃ CaCO₃↓
(4)Cu(OH)₂↓ Fe(OH)₃↓
(1)蓝 红
(2)Na₂SO₃ CaCO₃↓
(4)Cu(OH)₂↓ Fe(OH)₃↓
(四)酸碱反应
1. 酸碱反应:酸与碱作用生成盐和水的反应,属于复分解反应中的一种。
2. 酸碱反应的实质:
3. 酸碱反应在生产和生活中有很多应用,如农业上用熟石灰来改良酸性土壤,医学上用氢氧化铝来中和过多的胃酸以及石油工业上用氢氧化钠中和过量的硫酸等。
1. 酸碱反应:酸与碱作用生成盐和水的反应,属于复分解反应中的一种。
2. 酸碱反应的实质:
氢离子与氢氧根离子结合生成水分子
。3. 酸碱反应在生产和生活中有很多应用,如农业上用熟石灰来改良酸性土壤,医学上用氢氧化铝来中和过多的胃酸以及石油工业上用氢氧化钠中和过量的硫酸等。
答案:
氢离子与氢氧根离子结合生成水分子
1. 几种重要的盐。
(1)碳酸钠俗名为纯碱或苏打,其水溶液呈
(2)碳酸钙是难溶于水的白色固体,是石灰石和大理石的主要成分,用于建筑材料、白色涂料等。
(3)氯化钠俗称
(1)碳酸钠俗名为纯碱或苏打,其水溶液呈
碱性
,用于制造玻璃、造纸、纺织品、洗涤剂等。(2)碳酸钙是难溶于水的白色固体,是石灰石和大理石的主要成分,用于建筑材料、白色涂料等。
(3)氯化钠俗称
食盐
,溶解度受温度的影响不大,可用作融雪剂、腌制食品等。
答案:
(1)碱性
(3)食盐
(1)碱性
(3)食盐
2. 盐的性质。
(1)可溶性盐与某些金属反应,如:
$Fe+CuSO_4=$
(2)与某些酸反应,如:
$CaCO_3+2HCl=$
(3)可溶性盐与某些可溶性碱反应,如:
$Na_2CO_3+Ca(OH)_2=$
(4)可溶性盐与某些可溶性盐反应,如:
$NaCl+AgNO_3=$
(1)可溶性盐与某些金属反应,如:
$Fe+CuSO_4=$
FeSO₄+Cu
(2)与某些酸反应,如:
$CaCO_3+2HCl=$
CaCl₂+H₂O+CO₂↑
(3)可溶性盐与某些可溶性碱反应,如:
$Na_2CO_3+Ca(OH)_2=$
CaCO₃↓+2NaOH
(4)可溶性盐与某些可溶性盐反应,如:
$NaCl+AgNO_3=$
AgCl↓+NaNO₃
答案:
(1)FeSO₄+Cu
(2)CaCl₂+H₂O+CO₂↑
(3)CaCO₃↓+2NaOH
(4)AgCl↓+NaNO₃
(1)FeSO₄+Cu
(2)CaCl₂+H₂O+CO₂↑
(3)CaCO₃↓+2NaOH
(4)AgCl↓+NaNO₃
查看更多完整答案,请扫码查看


