2025年PASS教材搭档八年级化学全一册鲁教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年PASS教材搭档八年级化学全一册鲁教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. (9分)如图是甲烷燃烧的微观示意图,请回答下列问题。
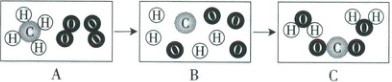
(1)在点燃的条件下,A到B的过程表示的是甲烷分子分解成碳原子和氢原子,氧分子分解成氧原子,B到C的过程表示的是
(2)该反应的化学方程式为
(3)由此微观示意图可知,

(1)在点燃的条件下,A到B的过程表示的是甲烷分子分解成碳原子和氢原子,氧分子分解成氧原子,B到C的过程表示的是
(一个)碳原子和(两个)氧原子结合成(一个)二氧化碳分子,(一个)氧原子和(两个)氢原子结合成(一个)水分子
;(2)该反应的化学方程式为
$CH_4+2O_2\stackrel{点燃}{=}CO_2+2H_2O$
。(3)由此微观示意图可知,
原子
是化学变化中最小的粒子。
答案:
11.
(1)(一个)碳原子和(两个)氧原子结合成(一个)二氧化碳分子,(一个)氧原子和(两个)氢原子结合成(一个)水分子
(2)$CH_4+2O_2\stackrel{点燃}{=}CO_2+2H_2O$
(3)原子解析:
(1)由图示可以看出,B图示表示的是氢原子、碳原子、氧原子,C图示表示的是水分子和二氧化碳分子,则B到C的过程表示的是一个碳原子和两个氧原子结合成一个二氧化碳分子,一个氧原子和两个氢原子结合成一个水分子。
(2)该反应过程是甲烷和氧气反应生成水和二氧化碳的过程。
(1)(一个)碳原子和(两个)氧原子结合成(一个)二氧化碳分子,(一个)氧原子和(两个)氢原子结合成(一个)水分子
(2)$CH_4+2O_2\stackrel{点燃}{=}CO_2+2H_2O$
(3)原子解析:
(1)由图示可以看出,B图示表示的是氢原子、碳原子、氧原子,C图示表示的是水分子和二氧化碳分子,则B到C的过程表示的是一个碳原子和两个氧原子结合成一个二氧化碳分子,一个氧原子和两个氢原子结合成一个水分子。
(2)该反应过程是甲烷和氧气反应生成水和二氧化碳的过程。
12. (18分)把A、B、C、D四种纯净物放在一密闭容器中反应,反应前后各物质的质量如下表:
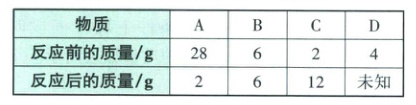
(1)该反应的生成物是
(2)该反应的基本反应类型是
(3)请写出一个与该反应类型相同的化学方程式:
(4)物质A是

(1)该反应的生成物是
C、D
,B可能是催化剂(或没有参与反应)
,反应后D的质量是20
g。(2)该反应的基本反应类型是
分解反应
。(3)请写出一个与该反应类型相同的化学方程式:
$2KClO_3\stackrel{MnO_2}{\underset{\triangle}{=}}2KCl+3O_2\uparrow$(合理即可)
。(4)物质A是
化合物
(填“单质”或“化合物”)。
答案:
12.
(1)C、D 催化剂(或没有参与反应) 20
(2)分解反应
(3)$2KClO_3\stackrel{MnO_2}{\underset{\triangle}{=}}2KCl+3O_2\uparrow$(合理即可)
(4)化合物
(1)C、D 催化剂(或没有参与反应) 20
(2)分解反应
(3)$2KClO_3\stackrel{MnO_2}{\underset{\triangle}{=}}2KCl+3O_2\uparrow$(合理即可)
(4)化合物
13. 化学兴趣小组的同学设计了下图实验装置(天平略)验证质量守恒定律。
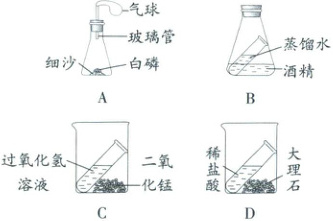
(1)A中气球的作用是
写出A中发生反应的化学方程式:
(2)上述四个实验装置中,只有A装置能直接用于验证质量守恒定律,B、C、D装置则不能。
①B装置不能用于验证质量守恒定律的原因:
②C装置和D装置不能直接用于验证质量守恒定律的原因:
(3)通过上述实验,同学们得出结论:当有气体参加或生成的反应,验证质量守恒定律时必须在
(4)从微观角度分析,在化学反应前后,一定不变的是
①原子种类
②分子种类
③原子数目
④分子数目
⑤原子质量
⑥分子质量
(5)三星堆出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,分解生成氧化铜、水和二氧化碳,根据质量守恒定律可得出该“绿色物质”一定含有

(1)A中气球的作用是
平衡装置内外压强,防止橡皮塞飞出
。写出A中发生反应的化学方程式:
$4P+5O_2\stackrel{点燃}{=}2P_2O_5$
。(2)上述四个实验装置中,只有A装置能直接用于验证质量守恒定律,B、C、D装置则不能。
①B装置不能用于验证质量守恒定律的原因:
不能发生化学反应
。②C装置和D装置不能直接用于验证质量守恒定律的原因:
反应生成了气体,且没有在密闭容器中进行
。(3)通过上述实验,同学们得出结论:当有气体参加或生成的反应,验证质量守恒定律时必须在
密闭
装置中进行。(4)从微观角度分析,在化学反应前后,一定不变的是
①③⑤
(填序号),所以质量守恒。①原子种类
②分子种类
③原子数目
④分子数目
⑤原子质量
⑥分子质量
(5)三星堆出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,分解生成氧化铜、水和二氧化碳,根据质量守恒定律可得出该“绿色物质”一定含有
4(或四)
种元素。
答案:
13.
(1)平衡装置内外压强,防止橡皮塞飞出 $4P+5O_2\stackrel{点燃}{=}2P_2O_5$
(2)①不能发生化学反应 ②反应生成了气体,且没有在密闭容器中进行
(3)密闭
(4)①③⑤
(5)4(或四)
解析:
(1)A装置中的白磷燃烧生成五氧化二磷的过程中放热,气球的作用是平衡装置内外压强,防止橡皮塞飞出。
(5)将“绿色物质”隔绝空气加热,分解生成氧化铜、水和二氧化碳,反应后有铜元素、氧元素、氢元素和碳元素,根据质量守恒定律,反应前后元素种类不变,该“绿色物质”一定含有Cu、O、H、C4种元素。
(1)平衡装置内外压强,防止橡皮塞飞出 $4P+5O_2\stackrel{点燃}{=}2P_2O_5$
(2)①不能发生化学反应 ②反应生成了气体,且没有在密闭容器中进行
(3)密闭
(4)①③⑤
(5)4(或四)
解析:
(1)A装置中的白磷燃烧生成五氧化二磷的过程中放热,气球的作用是平衡装置内外压强,防止橡皮塞飞出。
(5)将“绿色物质”隔绝空气加热,分解生成氧化铜、水和二氧化碳,反应后有铜元素、氧元素、氢元素和碳元素,根据质量守恒定律,反应前后元素种类不变,该“绿色物质”一定含有Cu、O、H、C4种元素。
14. 同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取$80g$该样品进行煅烧实验(反应的化学方程式为$CaCO_3\xlongequal{高温}CaO + CO_2↑$,所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:

请回答下列问题。
(1)当石灰石完全反应后,生成$CO_2$的质量为
(2)计算该石灰石中$CaCO_3$的质量分数(写出计算过程)。

请回答下列问题。
(1)当石灰石完全反应后,生成$CO_2$的质量为
22g
。(2)计算该石灰石中$CaCO_3$的质量分数(写出计算过程)。
答案:
14.
(1)22g
(2)解:设80g该石灰石中含$CaCO_3$的质量为x。
$CaCO_3\stackrel{高温}{=}CaO+CO_2\uparrow$
100 44
x 22g
$\frac{100}{44}=\frac{x}{22g}$ x=50g
该石灰石中$CaCO_3$的质量分数=$\frac{50g}{80g}$×100%=62.5%。
答:该石灰石中$CaCO_3$的质量分数为62.5%。
解析:分析表格数据可知,在$t_4$时固体质量不再减小,说明碳酸钙完全分解。根据质量守恒定律,生成二氧化碳的质量为80g-58g=22g。根据碳酸钙分解的化学方程式,找出碳酸钙与二氧化碳的质量关系,再根据二氧化碳的质量计算出碳酸钙的质量,从而可以计算出碳酸钙的质量分数。
(1)22g
(2)解:设80g该石灰石中含$CaCO_3$的质量为x。
$CaCO_3\stackrel{高温}{=}CaO+CO_2\uparrow$
100 44
x 22g
$\frac{100}{44}=\frac{x}{22g}$ x=50g
该石灰石中$CaCO_3$的质量分数=$\frac{50g}{80g}$×100%=62.5%。
答:该石灰石中$CaCO_3$的质量分数为62.5%。
解析:分析表格数据可知,在$t_4$时固体质量不再减小,说明碳酸钙完全分解。根据质量守恒定律,生成二氧化碳的质量为80g-58g=22g。根据碳酸钙分解的化学方程式,找出碳酸钙与二氧化碳的质量关系,再根据二氧化碳的质量计算出碳酸钙的质量,从而可以计算出碳酸钙的质量分数。
查看更多完整答案,请扫码查看


