2025年PASS教材搭档八年级化学全一册鲁教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年PASS教材搭档八年级化学全一册鲁教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. (8分)元素周期表是学习和研究化学的重要工具,试根据图示回答下列问题。

(1)图甲是铯元素在元素周期表中的信息,则铯元素属于
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同的元素,下列说法正确的是
A. 原子序数:$Z>Y$
B. 核外电子数:$X=Y$
C. Y和Z处于同一周期

(1)图甲是铯元素在元素周期表中的信息,则铯元素属于
金属
(填“金属”或“非金属”)元素,该元素原子的核外电子数为55
,质子数为55
。(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同的元素,下列说法正确的是
AC
(填字母)。A. 原子序数:$Z>Y$
B. 核外电子数:$X=Y$
C. Y和Z处于同一周期
答案:
12.
(1)金属 55 55
(2)AC
解析:
(1)铯带“钅”字旁,为金属元素,原子序数=核外电子数=核内质子数=55。
(2)在元素周期表中,同一周期元素的原子序数从左到右依次增大,故原子序数:Z>Y;不同元素的本质区别是质子数不同,X、Y不是同种元素,所以质子数不相等,故核外电子数不相等;同一行的元素属于同一周期,所以Y和Z处于同一周期。
(1)金属 55 55
(2)AC
解析:
(1)铯带“钅”字旁,为金属元素,原子序数=核外电子数=核内质子数=55。
(2)在元素周期表中,同一周期元素的原子序数从左到右依次增大,故原子序数:Z>Y;不同元素的本质区别是质子数不同,X、Y不是同种元素,所以质子数不相等,故核外电子数不相等;同一行的元素属于同一周期,所以Y和Z处于同一周期。
13. 科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论。
(1)汤姆孙发现了电子,他根据原子为电中性,推测
(2)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。
【过程与现象】1911年英国科学家卢瑟福进行了著名的$\alpha$粒子(带正电)轰击金箔实验。结果发现:绝大多数$\alpha$粒子能穿过金箔且不改变原来的方向,但有一小部分$\alpha$粒子改变了原来的前进方向,甚至有极少数$\alpha$粒子被反弹了回来。
【解释与结论】
①绝大多数$\alpha$粒子能穿过金箔且不改变原来的方向,说明
②一小部分$\alpha$粒子改变了原来的前进方向,说明
③极少数$\alpha$粒子被反弹了回来,说明
④通过上述实验,可推出原子结构模型为
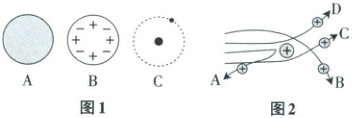
【分析与应用】(3)当$\alpha$粒子轰击金箔时,运动轨迹不可能是图2中的
(4)原子的质量很小,为计算和使用方便引入了相对原子质量的概念。下列关于相对原子质量的叙述正确的是
A. 相对原子质量是采用以小比小使数值变大的计量原理
B. 相对原子质量是一个原子的实际质量与一个碳-12原子实际质量的$\frac{1}{12}$的比值
C. 相对原子质量就是原子的实际质量
D. 采用相对原子质量后,原子的质量变大了
(1)汤姆孙发现了电子,他根据原子为电中性,推测
原子中还有带正电的物质
。(2)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。
【过程与现象】1911年英国科学家卢瑟福进行了著名的$\alpha$粒子(带正电)轰击金箔实验。结果发现:绝大多数$\alpha$粒子能穿过金箔且不改变原来的方向,但有一小部分$\alpha$粒子改变了原来的前进方向,甚至有极少数$\alpha$粒子被反弹了回来。
【解释与结论】
①绝大多数$\alpha$粒子能穿过金箔且不改变原来的方向,说明
原子核很小,原子内部有很大的空间
。②一小部分$\alpha$粒子改变了原来的前进方向,说明
原子核带正电
。③极少数$\alpha$粒子被反弹了回来,说明
原子内部有一个质量较大、体积很小的粒子
。④通过上述实验,可推出原子结构模型为
C
。(填图1中字母)
【分析与应用】(3)当$\alpha$粒子轰击金箔时,运动轨迹不可能是图2中的
BC
(填字母)。(4)原子的质量很小,为计算和使用方便引入了相对原子质量的概念。下列关于相对原子质量的叙述正确的是
AB
(填字母)。A. 相对原子质量是采用以小比小使数值变大的计量原理
B. 相对原子质量是一个原子的实际质量与一个碳-12原子实际质量的$\frac{1}{12}$的比值
C. 相对原子质量就是原子的实际质量
D. 采用相对原子质量后,原子的质量变大了
答案:
13.
(1)原子中还有带正电的物质
(2)①原子核很小,原子内部有很大的空间 ②原子核带正电 ③原子内部有一个质量较大、体积很小的粒子 ④C
(3)BC
(4)AB
解析:
(2)④通过实验可推出原子结构模型为中间有一个很小的核的模型。
(3)原子核带正电,当α粒子轰击金箔时,不可能靠近原子中的原子核,故运动轨迹不可能是图2中的BC。
(4)相对原子质量能反映原子实际质量的大小,但不是原子的实际质量,C错误;采用相对原子质量后,并不能增大原子的质量,D错误。
(1)原子中还有带正电的物质
(2)①原子核很小,原子内部有很大的空间 ②原子核带正电 ③原子内部有一个质量较大、体积很小的粒子 ④C
(3)BC
(4)AB
解析:
(2)④通过实验可推出原子结构模型为中间有一个很小的核的模型。
(3)原子核带正电,当α粒子轰击金箔时,不可能靠近原子中的原子核,故运动轨迹不可能是图2中的BC。
(4)相对原子质量能反映原子实际质量的大小,但不是原子的实际质量,C错误;采用相对原子质量后,并不能增大原子的质量,D错误。
14. (11分)(天津中考)维生素$C(C_6H_8O_6)$主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,计算:
(1)维生素C的相对分子质量:
(2)维生素C中碳、氢两种元素的质量比:
(3)维生素C中
(1)维生素C的相对分子质量:
176
。(2)维生素C中碳、氢两种元素的质量比:
9:1
。(写最简比)(3)维生素C中
氧
元素的质量分数最大。
答案:
14.
(1)176
(2)9:1
(3)氧
解析:
(1)维生素C的相对分子质量=12×6+1×8+16×6=176。
(2)维生素C中碳、氢两种元素的质量比=(12×6):(1×8)=9:1。
(3)维生素C中碳、氢、氧元素的质量比=(12×6):(1×8):(16×6)=72:8:96,因此维生素C中氧元素的质量分数最大。
(1)176
(2)9:1
(3)氧
解析:
(1)维生素C的相对分子质量=12×6+1×8+16×6=176。
(2)维生素C中碳、氢两种元素的质量比=(12×6):(1×8)=9:1。
(3)维生素C中碳、氢、氧元素的质量比=(12×6):(1×8):(16×6)=72:8:96,因此维生素C中氧元素的质量分数最大。
15. (15分)如图是某化肥标签说明,请回答下列问题。

(1)硝酸铵中氮、氢、氧三种元素的质量比为
(2)计算硝酸铵中氮元素的质量分数。
(3)该化肥中含硝酸铵的质量分数是多少?

(1)硝酸铵中氮、氢、氧三种元素的质量比为
7:1:12
。(写最简比)(2)计算硝酸铵中氮元素的质量分数。
(3)该化肥中含硝酸铵的质量分数是多少?
答案:
15.
(1)7:1:12
(2)解:硝酸铵中氮元素的质量分数为$\frac{14×2}{14×2+1×4+16×3}×100\%=35\%$。
答:硝酸铵中氮元素的质量分数为35%。
(3)解:该化肥中的含氮量为16.8%,则该化肥中硝酸铵的质量分数为$\frac{该化肥的含氮量}{硝酸铵中氮元素的质量分数}×100\%=\frac{16.8\%}{35\%}×100\%=48\%$。
答:该化肥中含硝酸铵的质量分数为48%。
解析:
(1)硝酸铵中氮、氢、氧三种元素的质量比为(14×2):(1×4):(16×3)=7:1:12。
(1)7:1:12
(2)解:硝酸铵中氮元素的质量分数为$\frac{14×2}{14×2+1×4+16×3}×100\%=35\%$。
答:硝酸铵中氮元素的质量分数为35%。
(3)解:该化肥中的含氮量为16.8%,则该化肥中硝酸铵的质量分数为$\frac{该化肥的含氮量}{硝酸铵中氮元素的质量分数}×100\%=\frac{16.8\%}{35\%}×100\%=48\%$。
答:该化肥中含硝酸铵的质量分数为48%。
解析:
(1)硝酸铵中氮、氢、氧三种元素的质量比为(14×2):(1×4):(16×3)=7:1:12。
查看更多完整答案,请扫码查看


