2025年PASS教材搭档八年级化学全一册鲁教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年PASS教材搭档八年级化学全一册鲁教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
知识点1 利用化学方程式计算的依据
1.依据化学方程式中物质的
1.依据化学方程式中物质的
实际质量
之比等于相对质量
之比,可以进行化学反应中的相关定量计算。
答案:
1.实际质量 相对质量
知识点2 利用化学方程式计算的步骤
2.步骤
设:设
写:写出反应的
找:找出反应物与生成物之间的质量关系,并将
列:列出
答:检查无误后简明地写出答案。
2.步骤
设:设
未知量
;写:写出反应的
化学方程式
;找:找出反应物与生成物之间的质量关系,并将
已知质量
与未知质量
写在对应的位置上;列:列出
比例式
,求解;答:检查无误后简明地写出答案。
答案:
2.未知量 化学方程式 已知质量 未知质量 比例式
1.利用化学方程式计算的依据是(
A.化学方程式表示了一种化学反应过程
B.化学方程式表示反应物、生成物和反应条件
C.化学方程式表示了反应前后反应物和生成物的质量关系
D.化学方程式中各反应物的质量比等于生成物的质量比
C
)。A.化学方程式表示了一种化学反应过程
B.化学方程式表示反应物、生成物和反应条件
C.化学方程式表示了反应前后反应物和生成物的质量关系
D.化学方程式中各反应物的质量比等于生成物的质量比
答案:
1.C 解析:利用化学方程式计算的依据是化学方程式表示了反应前后反应物和生成物的质量关系。
2. 两份质量相等的碳分别和一定量的氧气恰好反应生成$CO$和$CO_2$时,所消耗氧气的质量比为 (
A.1:1
B.1:2
C.3:8
D.3:4
B
)。A.1:1
B.1:2
C.3:8
D.3:4
答案:
2.B 解析:设碳的质量为12g,生成CO时消耗氧气的质量为x,生成CO₂时消耗氧气的质量为y,则
$2C + O₂ \xlongequal{点燃} 2CO; C + O₂ \xlongequal{点燃} CO₂。$
2×12 32 12 32
12 g x 12 g y
$\frac{2×12}{32}=\frac{12 g}{x},$$x = 16 g;\frac{12}{32}=\frac{12 g}{y},$y = 32 g。
消耗氧气的质量比为16g:32g = 1:2。
$2C + O₂ \xlongequal{点燃} 2CO; C + O₂ \xlongequal{点燃} CO₂。$
2×12 32 12 32
12 g x 12 g y
$\frac{2×12}{32}=\frac{12 g}{x},$$x = 16 g;\frac{12}{32}=\frac{12 g}{y},$y = 32 g。
消耗氧气的质量比为16g:32g = 1:2。
3. 在化学反应$aA + bB \longrightarrow cC + dD$中,8 g A与16 g B恰好完全反应生成10 g C,若12 g A与足量的B反应,则生成D的质量是(
A.20 g
B.24 g
C.15 g
D.21 g
D
)。A.20 g
B.24 g
C.15 g
D.21 g
答案:
3.D 解析:根据质量守恒定律,8g A与16g B反应生成10g C,同时生成8g + 16g - 10g = 14g D,设12g A与足量B反应生成D的质量为x,则$\frac{8 g}{12 g}=\frac{14 g}{x},$x = 21 g。
4. 等质量的碳、镁跟足量氧气反应生成$CO_2$、$MgO$,则碳比镁消耗氧气的质量(
A.多
B.相等
C.少
D.无法判断
A
)。A.多
B.相等
C.少
D.无法判断
答案:
4.A 解析:设碳和镁的质量为24g,碳消耗氧气的质量为x,镁消耗氧气的质量为y,则
$C + O₂ \xlongequal{点燃} CO₂$
12 32
24 g x
$\frac{12}{32}=\frac{24 g}{x},$x = 64 g
$2Mg + O₂ \xlongequal{点燃} 2MgO$
2×24 32
24 g y
$\frac{2×24}{32}=\frac{24 g}{y},$y = 16 g
64g > 16g,所以碳消耗氧气的质量多。
$C + O₂ \xlongequal{点燃} CO₂$
12 32
24 g x
$\frac{12}{32}=\frac{24 g}{x},$x = 64 g
$2Mg + O₂ \xlongequal{点燃} 2MgO$
2×24 32
24 g y
$\frac{2×24}{32}=\frac{24 g}{y},$y = 16 g
64g > 16g,所以碳消耗氧气的质量多。
5. 在$2X + Y \longrightarrow 3Z + 2W$反应中,若20 g X和15 g Y恰好完全反应生成5 g W,且Z的相对分子质量为60,则X的相对分子质量是(
A.40
B.50
C.60
D.70
C
)。A.40
B.50
C.60
D.70
答案:
5.C 解析:依据质量守恒定律,反应后Z的质量为20g + 15g - 5g = 30g,依据化学方程式计算,设X的相对分子质量为x,则
$2X + Y \xlongequal{} 3Z + 2W$
2x 3×60
20 g 30 g
$\frac{2x}{3×60}=\frac{20 g}{30 g},$x = 60。
$2X + Y \xlongequal{} 3Z + 2W$
2x 3×60
20 g 30 g
$\frac{2x}{3×60}=\frac{20 g}{30 g},$x = 60。
6.镁在空气中燃烧时,发生如下两个反应:$3Mg+N_2\xlongequal{点燃}Mg_3N_2,2Mg+O_2\xlongequal{点燃}2MgO$。
已知24 g镁在纯氧中完全燃烧可得40 g产物,那么24 g镁在空气中完全燃烧所得产物的质量(
A.等于40 g
B.小于40 g
C.大于40 g
D.无法确定
已知24 g镁在纯氧中完全燃烧可得40 g产物,那么24 g镁在空气中完全燃烧所得产物的质量(
B
)。相同质量的$Mg$生成$Mg_3N_2$的质量小。A.等于40 g
B.小于40 g
C.大于40 g
D.无法确定
答案:
6.B
7. 在一个密闭的钢筒内有甲、乙、丙、丁四种物质,在电火花作用下,充分发生反应,测得反应前后各物质的质量如下:
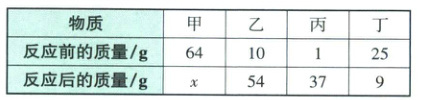
已知甲的相对分子质量为丁的2倍,则该反应的化学方程式中甲与丁的化学计量数之比为(
A.1:2
B.1:1
C.2:1
D.2:3

已知甲的相对分子质量为丁的2倍,则该反应的化学方程式中甲与丁的化学计量数之比为(
C
)。A.1:2
B.1:1
C.2:1
D.2:3
答案:
7.C 解析:根据质量守恒定律,x = 64 + 10 + 1 + 25 - 54 - 37 - 9 = 0,故甲减少的质量为64g,丁减少的质量为16g,所以化学反应中甲与丁的质量比为64g:16g = 4:1,而甲的相对分子质量为丁的2倍,所以该反应的化学方程式中甲与丁的化学计量数之比为2:1。
1.将0.5 g二氧化锰与一定量氯酸钾共热到质量不再减小为止,称得残渣质量为15.4 g。
求:(1)生成氧气多少克?
(2)原氯酸钾的质量是多少克?
$2KClO_3\xlongequal[△]{MnO_2}2KCl + 3O_2↑$
求:(1)生成氧气多少克?
(2)原氯酸钾的质量是多少克?
$2KClO_3\xlongequal[△]{MnO_2}2KCl + 3O_2↑$
答案:
1.解:反应前后催化剂的质量不变,反应后剩余物质为KCl和MnO₂,则KCl的质量为15.4g - 0.5g = 14.9g。
设生成氧气的质量为x,消耗KClO₃的质量为y。
$2KClO₃ \xlongequal[\triangle]{MnO₂} 2KCl + 3O₂↑$
2×122.5 2×74.5 3×32
y 14.9 g x
$\frac{2×74.5}{3×32}=\frac{14.9 g}{x},$x = 9.6 g
$\frac{2×122.5}{2×74.5}=\frac{y}{14.9 g},$y = 24.5 g
答:
(1)生成氧气的质量是9.6g。
(2)原氯酸钾的质量是24.5g。
设生成氧气的质量为x,消耗KClO₃的质量为y。
$2KClO₃ \xlongequal[\triangle]{MnO₂} 2KCl + 3O₂↑$
2×122.5 2×74.5 3×32
y 14.9 g x
$\frac{2×74.5}{3×32}=\frac{14.9 g}{x},$x = 9.6 g
$\frac{2×122.5}{2×74.5}=\frac{y}{14.9 g},$y = 24.5 g
答:
(1)生成氧气的质量是9.6g。
(2)原氯酸钾的质量是24.5g。
2. 为测定某大理石样品中碳酸钙的含量,取样品10 g于烧杯中,再向其中加入稀盐酸50 g,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7 g(反应原理:$CaCO_3 + 2HCl \longrightarrow CaCl_2 + CO_2↑ + H_2O$)。
(1)生成$CO_2$的质量为
(2)计算大理石样品中碳酸钙的质量分数。
(1)生成$CO_2$的质量为
3.3
g。(2)计算大理石样品中碳酸钙的质量分数。
答案:
2.
(1)3.3
(2)解:设10g大理石样品中碳酸钙的质量为x。
$CaCO₃ + 2HCl \xlongequal{} CaCl₂ + CO₂↑ + H₂O$
100 44
x 3.3 g
$\frac{100}{44}=\frac{x}{3.3 g},$x = 7.5 g
大理石样品中碳酸钙的质量分数为$\frac{7.5 g}{10 g}×100% = 75%。$
答:大理石样品中碳酸钙的质量分数为75%。
解析:
(1)由质量守恒定律知,反应生成CO₂的质量为10g + 50g - 56.7g = 3.3g。
(1)3.3
(2)解:设10g大理石样品中碳酸钙的质量为x。
$CaCO₃ + 2HCl \xlongequal{} CaCl₂ + CO₂↑ + H₂O$
100 44
x 3.3 g
$\frac{100}{44}=\frac{x}{3.3 g},$x = 7.5 g
大理石样品中碳酸钙的质量分数为$\frac{7.5 g}{10 g}×100% = 75%。$
答:大理石样品中碳酸钙的质量分数为75%。
解析:
(1)由质量守恒定律知,反应生成CO₂的质量为10g + 50g - 56.7g = 3.3g。
查看更多完整答案,请扫码查看


