2025年PASS教材搭档八年级化学全一册鲁教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年PASS教材搭档八年级化学全一册鲁教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
3.氢化钙($CaH_2$)遇水发生化学反应,生成氢氧化钙和氢气。为了测定某样品中氢化钙的含量,进行了如图所示实验,根据所提供数据计算[反应原理:$CaH_2 + 2H_2O \longrightarrow Ca(OH)_2 + 2H_2↑$]。
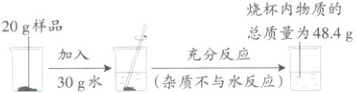
(1)生成氢气的质量是
(2)计算该样品中氢化钙的质量(写出计算过程)。

(1)生成氢气的质量是
1.6
g。(2)计算该样品中氢化钙的质量(写出计算过程)。
答案:
3.
(1)1.6
(2)解:设该样品中氢化钙的质量为x。
$CaH₂ + 2H₂O \xlongequal{} Ca(OH)₂ + 2H₂↑$
42 4
x 1.6 g
$\frac{42}{4}=\frac{x}{1.6 g},$x = 16.8 g
答:该样品中氢化钙的质量为16.8g。
解析:
(1)根据质量守恒定律,反应前后物质的总质量不变,则生成氢气的质量是20g + 30g - 48.4g = 1.6g。
(1)1.6
(2)解:设该样品中氢化钙的质量为x。
$CaH₂ + 2H₂O \xlongequal{} Ca(OH)₂ + 2H₂↑$
42 4
x 1.6 g
$\frac{42}{4}=\frac{x}{1.6 g},$x = 16.8 g
答:该样品中氢化钙的质量为16.8g。
解析:
(1)根据质量守恒定律,反应前后物质的总质量不变,则生成氢气的质量是20g + 30g - 48.4g = 1.6g。
工业上用电解水的方法制取氢气。电解4.5 t水,能制得氢气多少吨?同时得到氧气多少吨?下面是一位同学的解题过程,请同学们探究、评议。
解:设制得的氢气的质量为x,氧气的质量为y。

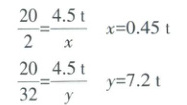
答:电解4.5 t水,可制得氢气0.45 t,氧气7.2 t。
(1)请你指出其中的错误:
(2)请写出正确的解法。
解:设制得的氢气的质量为x,氧气的质量为y。

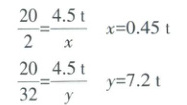
答:电解4.5 t水,可制得氢气0.45 t,氧气7.2 t。
(1)请你指出其中的错误:
水的相对质量计算错误,且化学方程式没配平,结果错误。
。(2)请写出正确的解法。
答案:
(1)水的相对质量计算错误,且化学方程式没配平,结果错误。
(2)解:设制得氢气的质量为x,得到氧气的质量为y。
$2H₂O \xlongequal{通电} 2H₂↑ + O₂↑$
2×18 2×2 32
4.5 t x y
$\frac{2×18}{2×2}=\frac{4.5 t}{x},$x = 0.5 t
$\frac{2×18}{32}=\frac{4.5 t}{y},$y = 4 t
答:电解4.5t水,能制得氢气0.5t,得到氧气4t。
(1)水的相对质量计算错误,且化学方程式没配平,结果错误。
(2)解:设制得氢气的质量为x,得到氧气的质量为y。
$2H₂O \xlongequal{通电} 2H₂↑ + O₂↑$
2×18 2×2 32
4.5 t x y
$\frac{2×18}{2×2}=\frac{4.5 t}{x},$x = 0.5 t
$\frac{2×18}{32}=\frac{4.5 t}{y},$y = 4 t
答:电解4.5t水,能制得氢气0.5t,得到氧气4t。
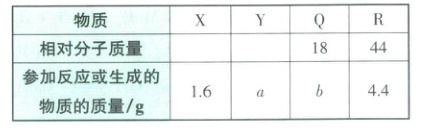
1. (随州中考)在反应$X + 2Y \longrightarrow 2Q + R$中,1.6 g X与足量的Y完全反应,生成4.4 g R,则$a:b$等于 (
A.23:9
B.46:9
C.32:9
D.16:9
D
)。
A.23:9
B.46:9
C.32:9
D.16:9
答案:
1.D 解析:由化学方程式$X + 2Y \xlongequal{} 2Q + R$可得,
$\frac{36}{44}=\frac{b}{4.4 g},$b = 3.6g。根据质量守恒定律可得,a = 4.4g + 3.6g - 1.6g = 6.4g,则a:b = 6.4g:3.6g = 16:9。
$\frac{36}{44}=\frac{b}{4.4 g},$b = 3.6g。根据质量守恒定律可得,a = 4.4g + 3.6g - 1.6g = 6.4g,则a:b = 6.4g:3.6g = 16:9。
2. (北京中考)实验室常用过氧化氢溶液与二氧化锰混合制取氧气。现将2.5 g二氧化锰放入盛有100 g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6 g气体。请完成下列问题。
(1)反应结束后,过滤、洗涤并烘干滤渣,称得滤渣的质量为
(2)计算原过氧化氢溶液中$H_2O_2$的质量。
(1)反应结束后,过滤、洗涤并烘干滤渣,称得滤渣的质量为
2.5
g。(2)计算原过氧化氢溶液中$H_2O_2$的质量。
答案:
2.
(1)2.5
(2)解:设原过氧化氢溶液中H₂O₂的质量为x。
$2H₂O₂ \xlongequal{MnO₂} 2H₂O + O₂↑$
68 32
x 1.6 g
$\frac{68}{32}=\frac{x}{1.6 g},$x = 3.4 g
答:原过氧化氢溶液中H₂O₂的质量为3.4g。
解析:
(1)二氧化锰是过氧化氢分解的催化剂,反应前后质量不发生变化,故反应后滤渣的质量为2.5g。
(1)2.5
(2)解:设原过氧化氢溶液中H₂O₂的质量为x。
$2H₂O₂ \xlongequal{MnO₂} 2H₂O + O₂↑$
68 32
x 1.6 g
$\frac{68}{32}=\frac{x}{1.6 g},$x = 3.4 g
答:原过氧化氢溶液中H₂O₂的质量为3.4g。
解析:
(1)二氧化锰是过氧化氢分解的催化剂,反应前后质量不发生变化,故反应后滤渣的质量为2.5g。
查看更多完整答案,请扫码查看


