2026年突唯中考中考总复习九年级化学全一册通用版河南专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年突唯中考中考总复习九年级化学全一册通用版河南专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第72页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
考点四 酸和碱的中和反应
1. 中和反应的定义及实质(高频考点)
酸与碱作用生成盐 和水的反应叫作中和反应。其微观实质是酸溶液中的${H^{+}}$与碱溶液中的${OH^{-}}$反应生成稳定的化合物${H_{2}O}$的过程。
注意:酸与碱发生反应的判断依据有酸碱指示剂变色;溶液$pH$发生变化;溶液温度变化(中和反应放热)。
温馨提示
复分解反应与中和反应:中和反应是指酸与碱作用生成盐和水的反应,因而中和反应一定属于复分解反应,但复分解反应不一定是中和反应;即中和反应是复分解反应的一种特例。
2. 盐
由金属离子(或铵根离子)和 酸根离子构成的化合物。
温馨提示
(1) 微观上,酸在水溶液中能解离出自由移动的$\boldsymbol{{H^{+}}}$离子和酸根离子;酸中均含有 氢元素。
(2) 微观上,碱在水溶液中能解离出自由移动的 $\boldsymbol{{OH^{-}}}$ 离子和金属 离子;碱中均含有氢、氧元素,不一定含有金属元素(如${NH_{3}· H_{2}O}$)。
(3) 微观上盐在水溶液中能解离出金属离子和酸根离子。盐中可能含有氢或氧元素,不一定有金属元素,如铵盐。
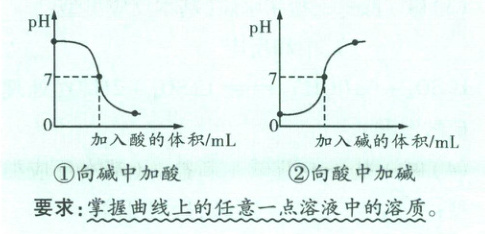
(4) 酸碱中和反应溶液$pH$的变化情况
① 向碱中加酸:$pH$从大于7逐渐减小,恰好完全反应时$pH = 7$,酸过量时$pH < 7$;
② 向酸中加碱:$pH$从小于7逐渐增大,恰好完全反应时$pH = 7$,碱过量时$pH > 7$。
要求:掌握曲线上的任意一点溶液中的溶质。
3. 中和反应的探究
(1) 实验原理(以氢氧化钠溶液与盐酸反应为例):${NaOH + HCl = NaCl + H_{2}O}$,酸碱中和反应的实质:$\boldsymbol{{H^{+} + OH^{-} = H_{2}O}}$。
(2) 指示剂的选择:一般选用酚酞溶液,向$NaOH$等碱溶液中滴入酚酞溶液,溶液变为红色;再逐滴滴入稀盐酸(或稀硫酸),边滴边振荡,至恰好变为无色时,溶液呈中性,标志着中和反应的反应终点。紫色石蕊溶液在碱溶液中呈蓝色,在中性溶液中呈紫色,蓝色与紫色之间没有明显的界线,反应现象不易观察,故不选其作中和反应的指示剂。
(3) 操作要点及$pH$的变化

① 取$NaOH$溶液,滴入几滴酚酞溶液,溶液变为红色,溶液显碱 性,此时$pH > 7$(即图像的起点),溶质有$NaOH$。
② 慢慢滴入稀盐酸,边滴边振荡(如在烧杯或锥形瓶中进行则可以用玻璃棒搅拌),此时$pH > 7$,溶液仍显碱性,为红色(如A点,溶质有$NaCl$,$NaOH$)。
③ 溶液恰好变为无色时停止滴入盐酸,此时酸碱恰好完全反应,$pH = 7$,显 中性(如B点,溶质有$NaCl$)。
④ 继续滴加过量盐酸,此时$pH < 7$,溶液显酸 性,为无色(如C点,溶质有$NaCl$,$HCl$)。
(4) 判断酸碱中和后溶液溶质的成分
① 在酸滴定碱的实验中,所得无色溶液中可能酸碱恰好完全反应,也可能酸过量。
② 检验酸过量的方法:滴加紫色石蕊溶液;用$pH$试纸;加入比较活泼的金属(镁、铝或锌);加入碳酸盐等。
(5) 注意事项
① 实验时,应逐滴滴入,且边滴加边搅拌(或振荡)。
② 盐酸与氢氧化钠溶液反应时无现象,加入碱之后再加入酚酞溶液,不能按照加入碱$\rightarrow$加入酸$\rightarrow$加入酚酞溶液的顺序。
4. 中和反应的应用
农业上,常用 $\boldsymbol{{Ca(OH)_{2}}}$改良酸性土壤;
医药上,常用${Mg(OH)_{2}}$治疗胃酸过多症;
工业上,含硫酸的废水可用碱性溶液来处理。
1. 中和反应的定义及实质(高频考点)
酸与碱作用生成盐 和水的反应叫作中和反应。其微观实质是酸溶液中的${H^{+}}$与碱溶液中的${OH^{-}}$反应生成稳定的化合物${H_{2}O}$的过程。
注意:酸与碱发生反应的判断依据有酸碱指示剂变色;溶液$pH$发生变化;溶液温度变化(中和反应放热)。
温馨提示
复分解反应与中和反应:中和反应是指酸与碱作用生成盐和水的反应,因而中和反应一定属于复分解反应,但复分解反应不一定是中和反应;即中和反应是复分解反应的一种特例。
2. 盐
由金属离子(或铵根离子)和 酸根离子构成的化合物。
温馨提示
(1) 微观上,酸在水溶液中能解离出自由移动的$\boldsymbol{{H^{+}}}$离子和酸根离子;酸中均含有 氢元素。
(2) 微观上,碱在水溶液中能解离出自由移动的 $\boldsymbol{{OH^{-}}}$ 离子和金属 离子;碱中均含有氢、氧元素,不一定含有金属元素(如${NH_{3}· H_{2}O}$)。
(3) 微观上盐在水溶液中能解离出金属离子和酸根离子。盐中可能含有氢或氧元素,不一定有金属元素,如铵盐。
(4) 酸碱中和反应溶液$pH$的变化情况
① 向碱中加酸:$pH$从大于7逐渐减小,恰好完全反应时$pH = 7$,酸过量时$pH < 7$;
② 向酸中加碱:$pH$从小于7逐渐增大,恰好完全反应时$pH = 7$,碱过量时$pH > 7$。
要求:掌握曲线上的任意一点溶液中的溶质。
3. 中和反应的探究
(1) 实验原理(以氢氧化钠溶液与盐酸反应为例):${NaOH + HCl = NaCl + H_{2}O}$,酸碱中和反应的实质:$\boldsymbol{{H^{+} + OH^{-} = H_{2}O}}$。
(2) 指示剂的选择:一般选用酚酞溶液,向$NaOH$等碱溶液中滴入酚酞溶液,溶液变为红色;再逐滴滴入稀盐酸(或稀硫酸),边滴边振荡,至恰好变为无色时,溶液呈中性,标志着中和反应的反应终点。紫色石蕊溶液在碱溶液中呈蓝色,在中性溶液中呈紫色,蓝色与紫色之间没有明显的界线,反应现象不易观察,故不选其作中和反应的指示剂。
(3) 操作要点及$pH$的变化

① 取$NaOH$溶液,滴入几滴酚酞溶液,溶液变为红色,溶液显碱 性,此时$pH > 7$(即图像的起点),溶质有$NaOH$。
② 慢慢滴入稀盐酸,边滴边振荡(如在烧杯或锥形瓶中进行则可以用玻璃棒搅拌),此时$pH > 7$,溶液仍显碱性,为红色(如A点,溶质有$NaCl$,$NaOH$)。
③ 溶液恰好变为无色时停止滴入盐酸,此时酸碱恰好完全反应,$pH = 7$,显 中性(如B点,溶质有$NaCl$)。
④ 继续滴加过量盐酸,此时$pH < 7$,溶液显酸 性,为无色(如C点,溶质有$NaCl$,$HCl$)。
(4) 判断酸碱中和后溶液溶质的成分
① 在酸滴定碱的实验中,所得无色溶液中可能酸碱恰好完全反应,也可能酸过量。
② 检验酸过量的方法:滴加紫色石蕊溶液;用$pH$试纸;加入比较活泼的金属(镁、铝或锌);加入碳酸盐等。

(5) 注意事项
① 实验时,应逐滴滴入,且边滴加边搅拌(或振荡)。
② 盐酸与氢氧化钠溶液反应时无现象,加入碱之后再加入酚酞溶液,不能按照加入碱$\rightarrow$加入酸$\rightarrow$加入酚酞溶液的顺序。
4. 中和反应的应用
农业上,常用 $\boldsymbol{{Ca(OH)_{2}}}$改良酸性土壤;
医药上,常用${Mg(OH)_{2}}$治疗胃酸过多症;
工业上,含硫酸的废水可用碱性溶液来处理。
答案:
1.盐
2.酸根
温馨提示
(1)氢 氢
(2)金属 氢氧根 氢 氧
3.
(1)H⁺ + OH⁻ = H₂O
(3)①碱 ③中 ④酸
4.熟石灰
2.酸根
温馨提示
(1)氢 氢
(2)金属 氢氧根 氢 氧
3.
(1)H⁺ + OH⁻ = H₂O
(3)①碱 ③中 ④酸
4.熟石灰
查看更多完整答案,请扫码查看


