2026年突唯中考中考总复习九年级化学全一册通用版河南专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年突唯中考中考总复习九年级化学全一册通用版河南专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
考点五 溶液的浓度
1. 溶质的质量分数
(1)适用于所有溶液:溶质的质量分数$=$
(2)某温度下,饱和溶液中,其溶质的质量分数$=$
饱和溶液中溶质的质量分数,也是该温度下最大的溶质的质量分数。
2. 溶液稀释(或浓缩)的计算
(1)$m( 浓)× w( 浓)=m( 稀)× w( 稀)$,$w$表示溶质质量分数。
(2)$m( 浓)+m( 水)=m( 稀)$。
注意:①溶液稀释后,溶剂的质量、溶液的质量都在增大,但溶质的质量不变,所以存在公式(1)。
②溶液稀释后,溶液的质量、体积、密度通常会改变,稀释前后溶液的质量关系如公式(2)所示。
③溶液的质量$(m)=$溶液的体积$(V)×$溶液的密度$(\rho)$。
1. 溶质的质量分数
(1)适用于所有溶液:溶质的质量分数$=$
$\frac{溶质质量}{溶液质量}×100\%=\frac{溶质质量}{溶质质量+溶剂质量}×100\%$
。(2)某温度下,饱和溶液中,其溶质的质量分数$=$
$\frac{溶解度}{溶解度+100g}×100\%$
。饱和溶液中溶质的质量分数,也是该温度下最大的溶质的质量分数。
2. 溶液稀释(或浓缩)的计算
(1)$m( 浓)× w( 浓)=m( 稀)× w( 稀)$,$w$表示溶质质量分数。
(2)$m( 浓)+m( 水)=m( 稀)$。
注意:①溶液稀释后,溶剂的质量、溶液的质量都在增大,但溶质的质量不变,所以存在公式(1)。
②溶液稀释后,溶液的质量、体积、密度通常会改变,稀释前后溶液的质量关系如公式(2)所示。
③溶液的质量$(m)=$溶液的体积$(V)×$溶液的密度$(\rho)$。
答案:
考点五
$1 (1)\frac{溶质质量}{溶液质量}×100\%=\frac{溶质质量}{溶质质量+溶剂质量}×100\% $
$(2)\frac{溶解度}{溶解度+100g}×100\%$
$1 (1)\frac{溶质质量}{溶液质量}×100\%=\frac{溶质质量}{溶质质量+溶剂质量}×100\% $
$(2)\frac{溶解度}{溶解度+100g}×100\%$
实验突破
实验一 一定溶质质量分数的溶液的配制
(高频考点)
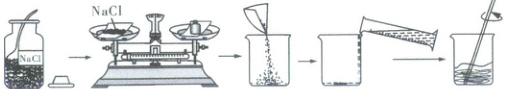
1. “可溶性固体+水”配制溶液
(1)实验用品
天平、称量纸、烧杯、玻璃棒、药匙、量筒(50 mL、100 mL)、胶头滴管、空试剂瓶、空白标签。
氯化钠、蒸馏水。
(2)实验步骤(配制50 g溶质质量分数为6%的氯化钠溶液)
①计算:需要氯化钠的质量为
②称量:用
③量取:用
(注意选取合适量程的量筒)。
④溶解:把量好的水倒入盛有氯化钠的烧杯中,用玻璃棒搅拌,加速氯化钠的溶解。
⑤装瓶贴标签:把配好的溶液装入试剂瓶中并贴上标签,放到试剂柜中。[标签上应标明试剂名称和溶液中溶质的质量分数]
(3)误差分析

2. “浓溶液+水”配制溶液
将浓溶液稀释为一定质量分数的稀溶液时,配制步骤为计算、量取、混匀、装瓶贴标签。
配制过程中不需要的仪器是天平和药匙。
实验二 粗盐中难溶性杂质的去除
制取粗盐有海水晒盐和井水煮盐两种方法。海水中含有可溶的氯化钠、氯化镁、氯化钙等物质和不溶的泥沙,因此粗盐是混合物。将粗盐中难溶性杂质去除,得到的最终产物精盐中仍然含有氯化镁、氯化钙等可溶物质的混合物。
1. 实验目的
去除不溶性杂质,通过溶解、过滤、蒸发操作得到精盐。
2. 实验用品
烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、天平、称量纸、滤纸、火柴。
粗盐、蒸馏水。
3. 实验步骤
溶解、过滤、蒸发、计算产率。
注意:四个步骤四次用到玻璃棒,其作用依次是
4. 实验注意事项
(1)过滤操作要注意“一贴、二低、三靠”。
(2)当蒸发皿中
(3)热的蒸发皿要用
5. 误差分析
(1)结果偏高:①过滤不干净;②水没有蒸干。
(2)结果偏低:①$NaCl$没有全部溶解,就开始过滤;②过滤或蒸发时液滴飞溅;③转移固体不完全。
注意:本实验是初中理化生实验考试的一个重要实验,需要反复练习,熟练掌握。
实验一 一定溶质质量分数的溶液的配制
(高频考点)
1. “可溶性固体+水”配制溶液
(1)实验用品
天平、称量纸、烧杯、玻璃棒、药匙、量筒(50 mL、100 mL)、胶头滴管、空试剂瓶、空白标签。
氯化钠、蒸馏水。
(2)实验步骤(配制50 g溶质质量分数为6%的氯化钠溶液)
①计算:需要氯化钠的质量为
$50\ g × 6\% = 3.0\ g$
;需要水的质量为$50\ g - 3.0\ g = 47\ g$
,水的密度近似为$1\ g· mL^{-1}$,水的体积为$47\ mL$
。②称量:用
天平
称量3.0 g氯化钠放入烧杯中。③量取:用
$50\ mL$量筒
量取47 mL水。(注意选取合适量程的量筒)。
④溶解:把量好的水倒入盛有氯化钠的烧杯中,用玻璃棒搅拌,加速氯化钠的溶解。
⑤装瓶贴标签:把配好的溶液装入试剂瓶中并贴上标签,放到试剂柜中。[标签上应标明试剂名称和溶液中溶质的质量分数]

(3)误差分析

2. “浓溶液+水”配制溶液
将浓溶液稀释为一定质量分数的稀溶液时,配制步骤为计算、量取、混匀、装瓶贴标签。
配制过程中不需要的仪器是天平和药匙。
实验二 粗盐中难溶性杂质的去除
制取粗盐有海水晒盐和井水煮盐两种方法。海水中含有可溶的氯化钠、氯化镁、氯化钙等物质和不溶的泥沙,因此粗盐是混合物。将粗盐中难溶性杂质去除,得到的最终产物精盐中仍然含有氯化镁、氯化钙等可溶物质的混合物。
1. 实验目的
去除不溶性杂质,通过溶解、过滤、蒸发操作得到精盐。
2. 实验用品
烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、天平、称量纸、滤纸、火柴。
粗盐、蒸馏水。
3. 实验步骤
溶解、过滤、蒸发、计算产率。
注意:四个步骤四次用到玻璃棒,其作用依次是
搅拌促进溶解
;引流
;搅拌,防止因局部温度过高,造成液滴飞溅
;转移固体物质
。4. 实验注意事项
(1)过滤操作要注意“一贴、二低、三靠”。
(2)当蒸发皿中
出现较多固体时
停止加热,利用蒸发皿的余热使滤液蒸干,以避免固体因受热而迸溅出来。(3)热的蒸发皿要用
坩埚钳
夹取,如需立即放在实验台上,要垫上陶土网
。5. 误差分析
(1)结果偏高:①过滤不干净;②水没有蒸干。
(2)结果偏低:①$NaCl$没有全部溶解,就开始过滤;②过滤或蒸发时液滴飞溅;③转移固体不完全。
注意:本实验是初中理化生实验考试的一个重要实验,需要反复练习,熟练掌握。
答案:
实验突破
实验一
1.
(2)①$50\ g × 6\% = 3.0\ g$ $50\ g - 3.0\ g = 47\ g$ $47\ mL$
②天平 ③$50\ mL$量筒
实验二
3.搅拌促进溶解 引流 搅拌,防止因局部温度过高,造成液滴飞溅 转移固体物质
4.
(2)出现较多固体时
(3)坩埚钳 陶土网
实验一
1.
(2)①$50\ g × 6\% = 3.0\ g$ $50\ g - 3.0\ g = 47\ g$ $47\ mL$
②天平 ③$50\ mL$量筒
实验二
3.搅拌促进溶解 引流 搅拌,防止因局部温度过高,造成液滴飞溅 转移固体物质
4.
(2)出现较多固体时
(3)坩埚钳 陶土网
查看更多完整答案,请扫码查看


