2026年突唯中考中考总复习九年级化学全一册通用版河南专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年突唯中考中考总复习九年级化学全一册通用版河南专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第64页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
海洋资源的综合利用与制盐
(2025 开封二模)浩瀚的海洋中蕴含着丰富的化学资源。同学们对海洋资源的综合利用展开了项目式探究活动。
活动一:海水淡化
(1) 海水淡化是解决淡水资源不足的重要方法。膜分离法(如图 1)可将海水淡化得到软水,下
列能大量通过淡化膜的微观粒子是
字母)。
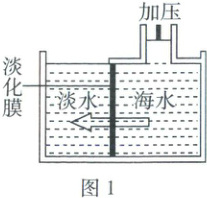
a. $ Na^+$
b. $ Cl^-$
c. $ Mg^{2+}$
d. $ H_2 O$
活动二:海水制镁
(2) 海水中含有较多氯化镁,人们从海水中提取金属镁的操作为①加石灰乳,②过滤,③加稀盐酸,④蒸发结晶,⑤电解熔融氯化镁。操作①发生反应的化学方程式为
(3) 我国化学家侯德榜创立了“侯氏制碱法”,利用海水为原料制取纯碱($ Na_2 CO_3$)的部分工艺流程如图 2 所示。已知粗盐水中含有氯化镁、硫酸钠、氯化钙等可溶性杂质。
①步骤 I 和 II 都涉及过滤,过滤操作中用到的玻璃仪器有漏斗、烧杯和
②步骤 I 所得滤液中含有哪些杂质?
③步骤IV 和 V 中可循环利用的物质是
④步骤 V 中碳酸氢钠在受热时分解生成纯碱、二氧化碳和水,写出该反应的化学方程式。
(4) 制取的纯碱产品中含有少量氯化钠。将 11 g 该产品加水溶解后滴加足量氯化钙溶液充分反应,过滤,洗涤干燥,得到 10 g 固体。计算该产品中纯碱的质量分数(精确到 0.1%)。

(2025 开封二模)浩瀚的海洋中蕴含着丰富的化学资源。同学们对海洋资源的综合利用展开了项目式探究活动。
活动一:海水淡化
(1) 海水淡化是解决淡水资源不足的重要方法。膜分离法(如图 1)可将海水淡化得到软水,下
列能大量通过淡化膜的微观粒子是
d
(填字母)。

a. $ Na^+$
b. $ Cl^-$
c. $ Mg^{2+}$
d. $ H_2 O$
活动二:海水制镁
(2) 海水中含有较多氯化镁,人们从海水中提取金属镁的操作为①加石灰乳,②过滤,③加稀盐酸,④蒸发结晶,⑤电解熔融氯化镁。操作①发生反应的化学方程式为
MgCl₂ + Ca(OH)₂══Mg(OH)₂↓ + CaCl₂
。操作③发生的反应属于基本反应类型中的复分解
反应。(3) 我国化学家侯德榜创立了“侯氏制碱法”,利用海水为原料制取纯碱($ Na_2 CO_3$)的部分工艺流程如图 2 所示。已知粗盐水中含有氯化镁、硫酸钠、氯化钙等可溶性杂质。
①步骤 I 和 II 都涉及过滤,过滤操作中用到的玻璃仪器有漏斗、烧杯和
玻璃棒
。②步骤 I 所得滤液中含有哪些杂质?
③步骤IV 和 V 中可循环利用的物质是
CO₂
。④步骤 V 中碳酸氢钠在受热时分解生成纯碱、二氧化碳和水,写出该反应的化学方程式。
(4) 制取的纯碱产品中含有少量氯化钠。将 11 g 该产品加水溶解后滴加足量氯化钙溶液充分反应,过滤,洗涤干燥,得到 10 g 固体。计算该产品中纯碱的质量分数(精确到 0.1%)。

答案:
(1)d
(2)MgCl₂ + Ca(OH)₂══Mg(OH)₂↓ + CaCl₂ 复分解
(3)①玻璃棒 ②NaCl、NaOH、Na₂CO₃ ③CO₂
$④2NaHCO₃\xlongequal[ ]{ △ }Na₂CO₃ + H₂O + CO₂↑$
(4)解:设该产品中纯碱的质量x。
Na₂CO₃ + CaCl₂══CaCO₃↓ + 2NaCl
106 100
x 10 g
$\frac{106}{100}=\frac{x}{10 g}$
x = 10.6 g
纯碱的质量分数$=\frac {10.6 g}{11 g}×100\% ≈ 96.4\%$
答:该产品中纯碱的质量分数为96.4%。
(1)d
(2)MgCl₂ + Ca(OH)₂══Mg(OH)₂↓ + CaCl₂ 复分解
(3)①玻璃棒 ②NaCl、NaOH、Na₂CO₃ ③CO₂
$④2NaHCO₃\xlongequal[ ]{ △ }Na₂CO₃ + H₂O + CO₂↑$
(4)解:设该产品中纯碱的质量x。
Na₂CO₃ + CaCl₂══CaCO₃↓ + 2NaCl
106 100
x 10 g
$\frac{106}{100}=\frac{x}{10 g}$
x = 10.6 g
纯碱的质量分数$=\frac {10.6 g}{11 g}×100\% ≈ 96.4\%$
答:该产品中纯碱的质量分数为96.4%。
查看更多完整答案,请扫码查看


