2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
1.下列物质的化学式,错误的是 (
A.重晶石 $\mathrm{BaCO_3}$
B.明矾 $\mathrm{KAl(SO_4)_2·12H_2O}$
C.石膏 $\mathrm{CaSO_4·2H_2O}$
D.绿矾 $\mathrm{FeSO_4·7H_2O}$
A
)A.重晶石 $\mathrm{BaCO_3}$
B.明矾 $\mathrm{KAl(SO_4)_2·12H_2O}$
C.石膏 $\mathrm{CaSO_4·2H_2O}$
D.绿矾 $\mathrm{FeSO_4·7H_2O}$
答案:
1.A[提示:A.重晶石的成分为硫酸钡,化学式为$\mathrm{BaSO_4}$,故A错误;B.明矾的成分为十二水合硫酸铝钾,化学式为$\mathrm{KAl(SO_4)_2·12H_2O}$,故B正确;C.石膏的成分为二水合硫酸钙,化学式为$\mathrm{CaSO_4·2H_2O}$,故C正确;D.绿矾为硫酸亚铁晶体,化学式为$\mathrm{FeSO_4·7H_2O}$,故D正确。]
2.下列“化学与生活”的说法错误的是 (
A.硫酸钡可用作白色颜料
B.石膏可用来调节水泥的凝固时间
C.胆矾可用于检验酒精中是否有水
D.硫酸可用来制药
C
)A.硫酸钡可用作白色颜料
B.石膏可用来调节水泥的凝固时间
C.胆矾可用于检验酒精中是否有水
D.硫酸可用来制药
答案:
2.C[提示:A.硫酸钡难溶于水和酸,可用作白色颜料,与$\mathrm{ZnS}$混合得到锌钡白颜料,A项正确;B.水泥工业制备需要用石膏调节水泥的硬化速率,石膏可用来调节水泥的凝固时间,B项正确;C.无水硫酸铜可用于检验酒精中是否有水,若变蓝,则证明有水的存在,其实质是无水硫酸铜变为五水硫酸铜(胆矾),C项错误;D.硫酸是重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,D项正确。]
3.对下列事实的解释正确的是 (
A.二氧化硫气体能用浓硫酸干燥,是因为二
氧化硫无还原性
B.医疗上可用硫酸钡作X射线透视肠胃的
内服药,是因为硫酸钡不溶于盐酸
C.向$50\ \mathrm{mL}\ 18\ \mathrm{mol/L}$的$\mathrm{H_2SO_4}$溶液中加
入足量的铜片加热充分反应后,被还原的
$\mathrm{H_2SO_4}$的物质的量等于$0.45\ \mathrm{mol}$
D.常温下,浓$\mathrm{H_2SO_4}$可以用铝制容器贮存,
说明铝与浓$\mathrm{H_2SO_4}$不反应
B
)A.二氧化硫气体能用浓硫酸干燥,是因为二
氧化硫无还原性
B.医疗上可用硫酸钡作X射线透视肠胃的
内服药,是因为硫酸钡不溶于盐酸
C.向$50\ \mathrm{mL}\ 18\ \mathrm{mol/L}$的$\mathrm{H_2SO_4}$溶液中加
入足量的铜片加热充分反应后,被还原的
$\mathrm{H_2SO_4}$的物质的量等于$0.45\ \mathrm{mol}$
D.常温下,浓$\mathrm{H_2SO_4}$可以用铝制容器贮存,
说明铝与浓$\mathrm{H_2SO_4}$不反应
答案:
3.B[提示:A.同种元素的不同价态之间若发生氧化还原反应,遵循价态归中不交叉,$\mathrm{SO_2}$中S显+4价,浓硫酸中S显+6价,无中间价态,所以$\mathrm{SO_2}$虽具有还原性,但不能被浓硫酸氧化,可用浓硫酸干燥二氧化硫,故A错误;B.胃酸中含HCl,硫酸钡不溶于盐酸,则医疗上可用硫酸钡作X射线透视肠胃的内服药,故B正确;C.浓硫酸和铜反应、稀硫酸和铜不反应,所以向$50\ \mathrm{mL}\ 18\ \mathrm{mol/L}$的$\mathrm{H_2SO_4}$溶液中加入足量的铜片加热充分反应后,在反应过程中浓硫酸变为稀硫酸后不和铜反应,所以被还原的$\mathrm{H_2SO_4}$的物质的量小于$0.45\ \mathrm{mol}$,故C错误;D.由于浓硫酸和铝在常温下发生钝化,阻止了反应的继续进行,所以常温下浓$\mathrm{H_2SO_4}$可以用铝制容器贮存,不是二者不反应,故D错误。]
4.下列四种溶液中,一定存在$\mathrm{SO_4^{2-}}$的是(
A.向甲溶液中加入$\mathrm{BaCl_2}$溶液,有白色沉淀
产生
B.向乙溶液中加入$\mathrm{BaCl_2}$溶液,有白色沉淀
产生,再加入盐酸沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,无白色沉
淀,再加入$\mathrm{BaCl_2}$溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡
溶液,有白色沉淀产生
C
)A.向甲溶液中加入$\mathrm{BaCl_2}$溶液,有白色沉淀
产生
B.向乙溶液中加入$\mathrm{BaCl_2}$溶液,有白色沉淀
产生,再加入盐酸沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,无白色沉
淀,再加入$\mathrm{BaCl_2}$溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡
溶液,有白色沉淀产生
答案:
4.C[提示:C.先加入稀盐酸,没有产生沉淀,排除$\mathrm{Ag^+}$、$\mathrm{SO_3^{2-}}$、$\mathrm{CO_3^{2-}}$等离子的影响,然后再加氯化钡溶液,产生白色沉淀,证明有$\mathrm{SO_4^{2-}}$存在,故C正确。]
5.为了除去粗盐中的$\mathrm{Ca^{2+}}$、$\mathrm{Mg^{2+}}$、$\mathrm{SO_4^{2-}}$,得到纯
净的$\mathrm{NaCl}$,可将粗盐溶于水,下列操作顺序
正确的是 (
①过滤 ②加入过量的$\mathrm{NaOH}$溶液 ③加
入过量的盐酸 ④加入过量的$\mathrm{Na_2CO_3}$溶液
⑤加入过量的$\mathrm{BaCl_2}$溶液 ⑥加热蒸发
A.④⑤②①③⑥
B.⑤①④②③⑥
C.②④⑤①③⑥
D.②⑤④①③⑥
净的$\mathrm{NaCl}$,可将粗盐溶于水,下列操作顺序
正确的是 (
D
)①过滤 ②加入过量的$\mathrm{NaOH}$溶液 ③加
入过量的盐酸 ④加入过量的$\mathrm{Na_2CO_3}$溶液
⑤加入过量的$\mathrm{BaCl_2}$溶液 ⑥加热蒸发
A.④⑤②①③⑥
B.⑤①④②③⑥
C.②④⑤①③⑥
D.②⑤④①③⑥
答案:
5.D[提示:首先,明确三种杂质离子分别用哪种试剂除去;其次,试剂必须过量,过量的试剂也要除去,因此要合理地选择加入试剂的顺序;最后,要明确加入盐酸的目的及何时加入。除$\mathrm{Ca^{2+}}$可用$\mathrm{Na_2CO_3}$溶液,除$\mathrm{Mg^{2+}}$可用$\mathrm{NaOH}$溶液,除$\mathrm{SO_4^{2-}}$可用$\mathrm{BaCl_2}$溶液。为将杂质离子全部除去,加入的试剂必须是过量的,过量的试剂必须在后面操作中除去。因此,$\mathrm{Na_2CO_3}$溶液必须在$\mathrm{BaCl_2}$溶液之后加入,否则过量的$\mathrm{Ba^{2+}}$无法除去,且盐酸需在过滤操作之后加入,除去过量的$\mathrm{CO_3^{2-}}$和$\mathrm{OH^-}$,最后加热蒸发除去HCl,结晶得到纯净的$\mathrm{NaCl}$。]
6.如图是硫元素在自然界中的循环示意图,下
列说法不正确的是 (
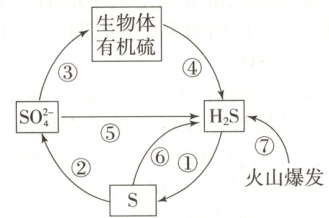
A.硫在自然界只有游离态
B.煤中含有硫元素,燃煤中加入生石灰可
脱硫
C.硫具有弱氧化性,和变价金属反应,通常将
金属氧化成低价态
D.硫化氢溶于水得到氢硫酸,氢硫酸是弱酸,
能与碱、碱性氧化物反应
列说法不正确的是 (
A
)
A.硫在自然界只有游离态
B.煤中含有硫元素,燃煤中加入生石灰可
脱硫
C.硫具有弱氧化性,和变价金属反应,通常将
金属氧化成低价态
D.硫化氢溶于水得到氢硫酸,氢硫酸是弱酸,
能与碱、碱性氧化物反应
答案:
6.A[提示:A.S元素在自然界中既有S单质,也有$\mathrm{H_2S}$、$\mathrm{SO_4^{2-}}$、有机硫等,故硫元素在自然界既有游离态又有化合态,A错误;B.燃煤中含有硫元素,煤燃烧时其中的硫元素转变为$\mathrm{SO_2}$,$\mathrm{SO_2}$可与加入的生石灰、$\mathrm{O_2}$反应产生$\mathrm{CaSO_4}$,可减少大气中硫元素的含量,达到脱硫的目的,B正确;C.S原子最外层有6个电子,原子半径比较大,因而S的氧化性比较弱,在和变价金属反应时,通常将变价金属氧化成低价态,C正确;D.硫化氢溶于水得到氢硫酸,氢硫酸是二元弱酸,具有酸的通性,能与碱、碱性氧化物反应产生盐和水,D正确。]
7.(2025·安徽名校联考)硫的价-类二维图如
图所示。下列分析错误的是 (

A.a只有还原性,在水溶液中不可能生成d
B.b与e的浓溶液反应可得到c
C.酸雨放置过程中酸性增强与f→e的转化
有关
D.可用e的溶液判断h中是否含有g
图所示。下列分析错误的是 (
A
)
A.a只有还原性,在水溶液中不可能生成d
B.b与e的浓溶液反应可得到c
C.酸雨放置过程中酸性增强与f→e的转化
有关
D.可用e的溶液判断h中是否含有g
答案:
7.A[提示:根据硫的价-类二维图,a是$\mathrm{H_2S}$、b是S、c是$\mathrm{SO_2}$、d是$\mathrm{SO_3}$、e是$\mathrm{H_2SO_4}$、f是$\mathrm{H_2SO_3}$、g是亚硫酸盐或亚硫酸氢盐、h是硫酸盐或硫酸氢盐。A.$\mathrm{H_2S}$中氢元素处于最高价,有氧化性,故A错误;B.根据归中反应规律,单质硫与浓硫酸可反应生成$\mathrm{SO_2}$,故B正确;C.酸雨中含有$\mathrm{H_2SO_3}$,放置过程中$\mathrm{H_2SO_3}$会被氧气氧化为强酸硫酸,故C正确;D.硫酸可与亚硫酸盐或亚硫酸氢盐反应生成具有刺激性气味的$\mathrm{SO_2}$,故D正确。]
1.【题型一】下列常见物质的俗名与化学式对
应正确的是 (
A.苏打——$\mathrm{Na_2CO_3}$
B.生石灰——$\mathrm{Ca(OH)_2}$
C.胆矾——$\mathrm{CuSO_4}$
D.生石膏——$\mathrm{CaCO_3}$
应正确的是 (
A
)A.苏打——$\mathrm{Na_2CO_3}$
B.生石灰——$\mathrm{Ca(OH)_2}$
C.胆矾——$\mathrm{CuSO_4}$
D.生石膏——$\mathrm{CaCO_3}$
答案:
1.A[提示:A.苏打是指碳酸钠,故A正确;B.生石灰是指CaO,熟石灰是指$\mathrm{Ca(OH)_2}$,故B错误;C.胆矾指$\mathrm{CuSO_4·5H_2O}$,故C错误;D.生石膏是指$\mathrm{CaSO_4·2H_2O}$,大理石或石灰石的主要成分是$\mathrm{CaCO_3}$,故D错误。]
查看更多完整答案,请扫码查看


