2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
1. 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的金属单质与被还原的硝酸的物质的量之比为$2 : 1$时,还原产物是
(
A.$NO_2$
B.$NO$
C.$N_2O$
D.$N_2$
(
C
)A.$NO_2$
B.$NO$
C.$N_2O$
D.$N_2$
答案:
1.C[提示:设金属的氧化产物中金属元素的化合价为$x$,硝酸中$N$元素的化合价变化值为$y$,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,因参加反应的金属单质与被还原的硝酸的物质的量之比为$2:1$,可知$2x=y$,所以硝酸中$N$元素的化合价变化应为偶数,而硝酸中$N$元素的化合价为$5$,即奇数,则硝酸被还原后的化合价为奇数,只有C符合题意。]
2. 足量金属镁与一定量浓硝酸反应,得到硝酸镁溶液和$NO_2$、$NO$的混合气体,这些气体与$2.52\ L\ O_2$(标准状况)混合后通入水中。所有气体完全被水吸收生成硝酸。若向所得硝酸镁溶液中加入$2.5\ mol/L\ NaOH$溶液至$Mg^{2+}$恰好完全沉淀,则消耗$NaOH$溶液的体积是
(
A.$45\ mL$
B.$180\ mL$
C.$90\ mL$
D.$135\ mL$
(
B
)A.$45\ mL$
B.$180\ mL$
C.$90\ mL$
D.$135\ mL$
答案:
2.B[提示:生成$NO_2$、$NO$的混合气体与$2.52\ L\ O_2$(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,由电子转移守恒,可知$Mg$提供的电子数等于氧气获得的电子数,$Mg$提供的电子为:$\frac{2.52\ L}{22.4\ L· mol^{-1}} × 4 = 0.45\ mol$,向所得硝酸镁溶液中加入$NaOH$溶液至$Mg^{2+}$恰好完全沉淀,沉淀为$Mg(OH)_2$,由电荷守恒可知,$Mg$提供电子的物质的量等于$Mg(OH)_2$中氢氧根离子的物质的量,故$n(NaOH)=0.45\ mol$,故消耗氢氧化钠溶液的体积为$\frac{0.45\ mol}{2.5\ mol· L^{-1}} = 0.18\ L = 180\ mL$,故选B。]
3. 物质的量之比为$2 : 5$的锌与硝酸反应,若硝酸被还原的产物为$N_2O$,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
(
A.$1 : 4$
B.$1 : 5$
C.$2 : 3$
D.$2 : 5$
(
A
)A.$1 : 4$
B.$1 : 5$
C.$2 : 3$
D.$2 : 5$
答案:
3.A[提示:设$Zn$为$2\ mol$,$HNO_3$为$5\ mol$,锌与硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,$2\ mol$锌失去$4\ mol$电子,生成$2\ mol$锌离子,由于生成硝酸锌,则其结合的硝酸根离子是$4\ mol$,剩余的$1\ mol$硝酸被还原为$N_2O$就得到$4\ mol$电子,说明硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是$1:4$,反应的化学方程式为$4Zn + 10HNO_3 \xlongequal{} 4Zn(NO_3)_2 + N_2O\uparrow + 5H_2O$,故选A。]
4. (2025·河南开封质检)某稀硫酸和稀硝酸的混合溶液体积为$100\ mL$,向其中逐渐加入铁粉,产生气体体积(已折合成标准状况下)随加入铁粉的质量变化如图所示。下列说法正确的是(已知:硝酸只被还原为$NO$气体,忽略反应过程中溶液体积的变化$)$ (
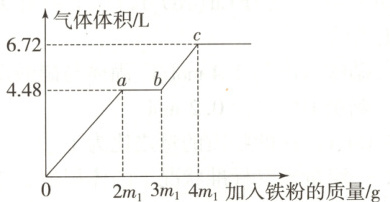
A.当加入$4m_1\ g$铁粉时,反应后溶液中的溶质为$FeSO_4$和$Fe(NO_3)_2$
B.混合溶液中$HNO_3$的物质的量浓度为$0.2\ mol/L$
C.转移电子的物质的量之比$n(Oa) : n(ab)$
$: n(bc) = 3 : 1 : 1$
D.$100\ mL$该混合溶液最多能溶解$12.8\ g$铜粉
C
)
A.当加入$4m_1\ g$铁粉时,反应后溶液中的溶质为$FeSO_4$和$Fe(NO_3)_2$
B.混合溶液中$HNO_3$的物质的量浓度为$0.2\ mol/L$
C.转移电子的物质的量之比$n(Oa) : n(ab)$
$: n(bc) = 3 : 1 : 1$
D.$100\ mL$该混合溶液最多能溶解$12.8\ g$铜粉
答案:
4.C[提示:根据图像分析可得$Oa$段的反应为:$Fe + NO_3^- + 4H^+ \xlongequal{} Fe^{3+} + NO\uparrow + 2H_2O$,$ab$段的反应为:$Fe + 2Fe^{3+} \xlongequal{} 3Fe^{2+}$,$bc$段的反应为:$Fe + 2H^+ \xlongequal{} Fe^{2+} + H_2\uparrow$,据此分析。当加入$4m_1\ g$铁粉时,反应后溶液中的溶质只有$FeSO_4$,故A错误;B.根据$Oa$段的反应关系计算:
$Fe + NO_3^- + 4H^+ \xlongequal{} Fe^{3+} + NO\uparrow + 2H_2O$
$1$
$0.2\ mol$
$\frac{4.48\ L}{22.4\ L· mol^{-1}} = 0.2\ mol$
则混合溶液中$HNO_3$的物质的量浓度为$\frac{0.2\ mol}{0.1\ L} = 2\ mol/L$,故B错误;C.由图可知三个阶段消耗的铁粉的物质的量之比:$n(Oa):n(ab):n(bc) = (2 × 3):(1 × 2):(1 × 2) = 3:1:1$,故C正确;D.由以上分析可知,混合溶液中硝酸的物质的量是$0.2\ mol$,结合反应计算:
$3Cu + 2NO_3^- + 8H^+ \xlongequal{} 3Cu^{2+} + 2NO\uparrow + 4H_2O$
$3$ $2$
$n(Cu) 0.2\ mol$
可得$n(Cu) = 0.3\ mol$,即$19.2\ g$,故D错误。故选C。]
$Fe + NO_3^- + 4H^+ \xlongequal{} Fe^{3+} + NO\uparrow + 2H_2O$
$1$
$0.2\ mol$
$\frac{4.48\ L}{22.4\ L· mol^{-1}} = 0.2\ mol$
则混合溶液中$HNO_3$的物质的量浓度为$\frac{0.2\ mol}{0.1\ L} = 2\ mol/L$,故B错误;C.由图可知三个阶段消耗的铁粉的物质的量之比:$n(Oa):n(ab):n(bc) = (2 × 3):(1 × 2):(1 × 2) = 3:1:1$,故C正确;D.由以上分析可知,混合溶液中硝酸的物质的量是$0.2\ mol$,结合反应计算:
$3Cu + 2NO_3^- + 8H^+ \xlongequal{} 3Cu^{2+} + 2NO\uparrow + 4H_2O$
$3$ $2$
$n(Cu) 0.2\ mol$
可得$n(Cu) = 0.3\ mol$,即$19.2\ g$,故D错误。故选C。]
5. (2025·山东沂水一中月考)$38.4\ g$铜与适量浓硝酸恰好反应生成氮的氧化物,这些氧化物恰好溶解在$NaOH$溶液中得到$NaNO_3$和$NaNO_2$的混合溶液,反应过程及有关数据如下图所示:
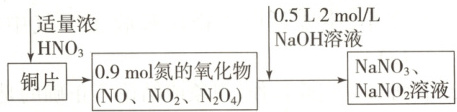
下列有关判断正确的是
(
A.若浓硝酸体积为$200\ mL$,则其物质的量浓度为$11\ mol/L$
B.$NO$、$NO_2$、$N_2O_4$和$NaOH$溶液反应时,$NO_2$、$N_2O_4$仅作还原剂
C.生成$0.2\ mol\ NaNO_3$和$0.8\ mol\ NaNO_2$
D.硝酸在反应中仅体现氧化性

下列有关判断正确的是
(
A
)A.若浓硝酸体积为$200\ mL$,则其物质的量浓度为$11\ mol/L$
B.$NO$、$NO_2$、$N_2O_4$和$NaOH$溶液反应时,$NO_2$、$N_2O_4$仅作还原剂
C.生成$0.2\ mol\ NaNO_3$和$0.8\ mol\ NaNO_2$
D.硝酸在反应中仅体现氧化性
答案:
5.A
[提示:A.铜和硝酸反应生成硝酸铜和氮的化合物,$n(Cu) = \frac{38.4\ g}{64\ g· mol^{-1}} = 0.6\ mol$,生成硝酸铜$0.6\ mol$,含有硝酸根离子$1.2\ mol$,氮的化合物为$0.9\ mol$,与氢氧化钠恰好完全反应生成$NaNO_3$和$NaNO_2$,根据原子守恒可知:$n(Na) = n(N) = n(NaOH) = 0.5\ L × 2\ mol/L = 1\ mol$,所以硝酸的总物质的量为$(1.2 + 1)\ mol = 2.2\ mol$,若浓硝酸体积为$200\ mL$,则其物质的量浓度为$\frac{2.2\ mol}{0.2\ L} = 11\ mol/L$,A正确;B.$NO$、$NO_2$、$N_2O_4$和$NaOH$溶液反应时生成$NaNO_3$和$NaNO_2$,$NO_2$、$N_2O_4$中氮元素为$+4$价,既可升高到$+5$价,又可降低到$+3$价,既作氧化剂,又作还原剂,B错误;C.$0.6\ mol\ Cu$失去的电子数等于$HNO_3$到$NaNO_2$得到的电子数,$0.6\ mol × (2 - 0) = n(NaNO_2) × (5 - 3)$,计算得出$n(NaNO_2) = 0.6\ mol$,根据题中信息可知$n(NaOH) = 0.5\ L × 2\ mol/L = 1\ mol$,则由$Na$原子守恒可以知道,$n(NaOH) = n(NaNO_2) + n(NaNO_3)$,则$n(NaNO_3) = 1\ mol - 0.6\ mol = 0.4\ mol$,C错误;D.铜和硝酸反应生成硝酸铜和氮的化合物,硝酸部分被还原,作氧化剂,部分生成盐,表现出酸性,D错误。]
[提示:A.铜和硝酸反应生成硝酸铜和氮的化合物,$n(Cu) = \frac{38.4\ g}{64\ g· mol^{-1}} = 0.6\ mol$,生成硝酸铜$0.6\ mol$,含有硝酸根离子$1.2\ mol$,氮的化合物为$0.9\ mol$,与氢氧化钠恰好完全反应生成$NaNO_3$和$NaNO_2$,根据原子守恒可知:$n(Na) = n(N) = n(NaOH) = 0.5\ L × 2\ mol/L = 1\ mol$,所以硝酸的总物质的量为$(1.2 + 1)\ mol = 2.2\ mol$,若浓硝酸体积为$200\ mL$,则其物质的量浓度为$\frac{2.2\ mol}{0.2\ L} = 11\ mol/L$,A正确;B.$NO$、$NO_2$、$N_2O_4$和$NaOH$溶液反应时生成$NaNO_3$和$NaNO_2$,$NO_2$、$N_2O_4$中氮元素为$+4$价,既可升高到$+5$价,又可降低到$+3$价,既作氧化剂,又作还原剂,B错误;C.$0.6\ mol\ Cu$失去的电子数等于$HNO_3$到$NaNO_2$得到的电子数,$0.6\ mol × (2 - 0) = n(NaNO_2) × (5 - 3)$,计算得出$n(NaNO_2) = 0.6\ mol$,根据题中信息可知$n(NaOH) = 0.5\ L × 2\ mol/L = 1\ mol$,则由$Na$原子守恒可以知道,$n(NaOH) = n(NaNO_2) + n(NaNO_3)$,则$n(NaNO_3) = 1\ mol - 0.6\ mol = 0.4\ mol$,C错误;D.铜和硝酸反应生成硝酸铜和氮的化合物,硝酸部分被还原,作氧化剂,部分生成盐,表现出酸性,D错误。]
6. 将$m\ g\ Fe$、$Cu$合金投入足量稀硝酸中,固体完全溶解,共收集到$2.24\ L$(标准状况)$NO$气体,向反应后的溶液中加入过量的$NaOH$溶液,下列判断正确的是
(
A.$Fe$、$Cu$和稀硝酸反应,稀硝酸只表现了氧化性
B.最终所得溶液中溶质只有一种
C.整个过程中有$0.1\ mol$电子发生转移
D.理论上沉淀的质量为$(m + 5.1)g$
(
D
)A.$Fe$、$Cu$和稀硝酸反应,稀硝酸只表现了氧化性
B.最终所得溶液中溶质只有一种
C.整个过程中有$0.1\ mol$电子发生转移
D.理论上沉淀的质量为$(m + 5.1)g$
答案:
6.D[提示:A.$Fe$、$Cu$和稀$HNO_3$反应,稀硝酸既表现了氧化性又表现了酸性,A项错误;B.所得溶液中溶质有$NaNO_3$和过量的$NaOH$两种,B项错误;C.$NO$的物质的量为$0.1\ mol$,合金与稀硝酸反应中转移$0.3\ mol$电子,C项错误;D.最后得到的沉淀是$Fe(OH)_3$,和$Cu(OH)_2$,沉淀的质量等于合金的质量和增加的$OH^-$的质量之和,而增加的$OH^-$的物质的量也等于整个过程中转移电子的物质的量,即增加的$OH^-$的物质的量也是$0.3\ mol$,所以理论上沉淀的质量为$m\ g + 0.3\ mol × 17\ g/mol = (m + 5.1)\ g$,D项正确。]
7. 向$100\ mL$稀$H_2SO_4$与稀$HNO_3$的混合溶液中加入$1.92\ g$铜粉,加热使其充分反应。已知稀$HNO_3$和稀$H_2SO_4$的物质的量浓度分别为$0.1\ mol/L$和$0.4\ mol/L$。下列说法正确的是(忽略反应前后溶液的体积变化$)$
(
A.所得溶液中$c(H^+) = 0.5\ mol/L$
B.所得溶液中$c(Cu^{2+}) = 0.225\ mol/L$
C.反应中转移$0.06\ mol$的电子
D.所得气体在标准状况下的体积为$0.448\ L$
(
A
)A.所得溶液中$c(H^+) = 0.5\ mol/L$
B.所得溶液中$c(Cu^{2+}) = 0.225\ mol/L$
C.反应中转移$0.06\ mol$的电子
D.所得气体在标准状况下的体积为$0.448\ L$
答案:
7.A[提示:$n(Cu) = 1.92\ g ÷ 64\ g/mol = 0.03\ mol$,$n(H^+) = 0.4\ mol/L × 0.1\ L × 2 + 0.1\ mol/L × 0.1\ L = 0.09\ mol$,$n(NO_3^-) = 0.1\ mol/L × 0.1\ L = 0.01\ mol$,由反应$3Cu + 8H^+ + 2NO_3^- \xlongequal{} 3Cu^{2+} + 2NO\uparrow + 4H_2O$可得,显然硝酸根离子的物质的量不足,由硝酸根离子的物质的量及离子方程式可知$0.01\ mol$硝酸根离子发生了反应,据此解答。A.由分析可知,$0.01\ mol$硝酸根离子发生反应时消耗$H^+$的物质的量为$0.04\ mol$,所得溶液中剩余$c(H^+) = \frac{0.09 - 0.04}{0.1} mol· L^{-1} = 0.5\ mol· L^{-1}$,故A正确;B.由分析可知,$0.01\ mol$硝酸根离子发生反应时消耗$Cu$的物质的量为$0.015\ mol$,所得溶液中$c(Cu^{2+}) = \frac{0.015}{0.1} mol· L^{-1} = 0.15\ mol· L^{-1}$,故B错误;C.由反应离子方程式可知,$0.01\ mol$硝酸根离子发生反应,转移$0.03\ mol$的电子,故C错误;D.由分析可知,$0.01\ mol$硝酸根离子发生反应生成气体$0.01\ mol$,在标准状况下的体积为$0.224\ L$,故D错误。]
查看更多完整答案,请扫码查看


