2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
2.【题型二、三】(2025·四川仁寿高中期末)某实验小组用$5\%\ H_2O_2$溶液、$MnO_2$粉末和蒸馏水探究外界条件对过氧化氢分解速率的影响,实验记录如表所示。
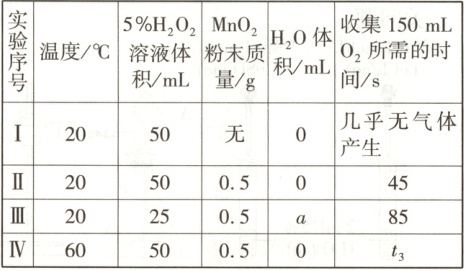
下列说法不正确的是(忽略因混合而导致的溶液体积变化) (
A.对比实验Ⅰ、Ⅱ可知,$MnO_2$粉末可加快反应速率
B.研究$H_2O_2$浓度对该反应速率的影响,$a=25$
C.实验Ⅰ、Ⅳ研究温度对过氧化氢分解速率的影响
D.结合表中数据,推测$t_3<45$

下列说法不正确的是(忽略因混合而导致的溶液体积变化) (
C
)A.对比实验Ⅰ、Ⅱ可知,$MnO_2$粉末可加快反应速率
B.研究$H_2O_2$浓度对该反应速率的影响,$a=25$
C.实验Ⅰ、Ⅳ研究温度对过氧化氢分解速率的影响
D.结合表中数据,推测$t_3<45$
答案:
2.C[提示:实验Ⅰ和Ⅱ的温度、H₂O₂浓度相同,在有MnO₂和无MnO₂的条件下反应,所以对比实验Ⅰ、Ⅱ可知,MnO₂粉末可加快反应速率,A项正确;在相同温度和都加入催化剂的条件下,实验Ⅱ和Ⅲ可以研究H₂O₂浓度对该反应速率的影响,溶液的总体积相同,所以a=25,B项正确;实验Ⅰ、Ⅳ中,温度不同,Ⅰ中没有催化剂,Ⅳ中加了催化剂,有2个变量,不能研究温度对过氧化氢分解速率的影响,C项错误;结合表中数据,对比实验Ⅱ和Ⅳ,其他条件相同,Ⅳ的温度高于Ⅱ的,所以反应速率较快,可以推测t₃<45,D项正确。]
3.【题型一】已知某条件下,合成氨的数据如下表。(已知:$N_2+3H_2 \xrightarrow[催化剂]{高温、高压} 2NH_3$)
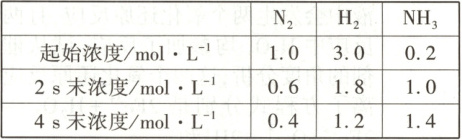
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 (
A.2 s末氨气的反应速率为$0.4\ \mathrm{mol/(L· s)}$
B.前2 s时间内氨气的平均反应速率为$0.4\ \mathrm{mol/(L· s)}$
C.前4 s时间内氨气的平均反应速率为$0.3\ \mathrm{mol/(L· s)}$
D.2~4 s时间内氨气的平均反应速率为$0.2\ \mathrm{mol/(L· s)}$

当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 (
A
)A.2 s末氨气的反应速率为$0.4\ \mathrm{mol/(L· s)}$
B.前2 s时间内氨气的平均反应速率为$0.4\ \mathrm{mol/(L· s)}$
C.前4 s时间内氨气的平均反应速率为$0.3\ \mathrm{mol/(L· s)}$
D.2~4 s时间内氨气的平均反应速率为$0.2\ \mathrm{mol/(L· s)}$
答案:
3.A[提示:化学反应速率是平均反应速率,而不是瞬时速率,A错误;前2s时间内氨气的平均反应速率为$\frac {(1.0 - 0.2)mol·L^{-1}}{2s}$=0.4mol/(L·s),B正确;前4s时间内氨气的平均反应速率为$\frac {(1.4 - 1.0)mol·L^{-1}}{4s}$=0.1mol/(L·s),C正确;2~4s时间内氨气的平均反应速率为$\frac {(1.4 - 1.0)mol·L^{-1}}{2s}$=0.2mol/(L·s),D正确。]
4.【题型三】反应$C(s)+H_2O(g)\rightleftharpoons CO(g)+H_2(g)$在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是 (
①增大C的量 ②将容器体积缩小一半 ③保持温度和体积不变,充入氦气 ④保持温度和压强不变,充入氦气 ⑤升高水蒸气的温度
A.①②③④
B.①③
C.②③④
D.①②③④⑤
B
)①增大C的量 ②将容器体积缩小一半 ③保持温度和体积不变,充入氦气 ④保持温度和压强不变,充入氦气 ⑤升高水蒸气的温度
A.①②③④
B.①③
C.②③④
D.①②③④⑤
答案:
4.B[提示:①因为C是固体,所以增大C的量对反应速率无影响;②将容器体积缩小一半,c(H₂O)、c(CO)、c(H₂)均增大,故反应速率增大;③保持温度和体积不变,充入氦气,浓度并没有发生改变,不影响化学反应速率;④保持温度和压强不变,充入氦气,导致容器的体积增大,使反应物的浓度减小,致使反应速率减小;⑤升温使反应速率增大。]
5.【题型一、三】一定温度下,在某密闭容器中发生反应:$2HI(g)\rightleftharpoons H_2(g)+I_2(s)$,若0~15 s内$c(HI)$由$0.1\ \mathrm{mol/L}$减小到$0.07\ \mathrm{mol/L}$,则下列说法正确的是 (
A.0~15 s内用$I_2$表示的平均反应速率为$v(I_2)=0.001\ \mathrm{mol/(L· s)}$
B.$c(HI)$由$0.07\ \mathrm{mol/L}$降到$0.05\ \mathrm{mol/L}$所需时间小于10 s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
D
)A.0~15 s内用$I_2$表示的平均反应速率为$v(I_2)=0.001\ \mathrm{mol/(L· s)}$
B.$c(HI)$由$0.07\ \mathrm{mol/L}$降到$0.05\ \mathrm{mol/L}$所需时间小于10 s
C.升高温度正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
答案:
5.D[提示:I₂为固态,故不能用它表示化学反应速率,A错误;v(HI)=$\frac {0.1mol·L^{-1}-0.07mol·L^{-1}}{15s}$=0.002mol/(L·s),若反应一直以该速率进行,则t=$\frac {0.07mol·L^{-1}-0.05mol·L^{-1}}{0.002mol·L^{-1}·s^{-1}}$=10s,但随着反应的进行,反应物浓度降低,反应速率减慢,所用时间应大于10s,B错误;升高温度,正、逆反应速率均加快,C错误;减小反应体系的体积,即增大了压强,化学反应速率加快,D正确。]
6. (2025·湖南长沙雅礼中学月考)用过量铁片与稀盐酸反应,为加快其反应速率而生成氢气的量不变,下列措施中可行的是 (
①以铁屑代替铁片 ②用过量锌片代替铁片 ③在稀盐酸中加入$CH_3COONa$固体 ④在稀盐酸中加入等物质的量浓度的硫酸 ⑤在稀盐酸中加入$NaNO_3$固体
A.①②③
B.①②
C.②④⑤
D.全部都可行
B
)①以铁屑代替铁片 ②用过量锌片代替铁片 ③在稀盐酸中加入$CH_3COONa$固体 ④在稀盐酸中加入等物质的量浓度的硫酸 ⑤在稀盐酸中加入$NaNO_3$固体
A.①②③
B.①②
C.②④⑤
D.全部都可行
答案:
6.B[提示:①以铁屑代替铁片,增大了接触面积,反应速率加快,故①正确;②用过量锌片代替铁片,锌比铁活泼,反应速率加快,故②正确;③在稀盐酸中加入CH₃COONa固体,生成弱酸,氢离子浓度降低,反应速率减慢,故③错误;④在稀盐酸中加入等物质的量浓度的硫酸,氢离子浓度增大,反应速率加快,但生成氢气的量增加,故④错误;⑤在稀盐酸中加入NaNO₃固体,硝酸根离子与氢离子构成硝酸,生成氮的氧化物,而不生成氢气,故⑤错误。故选B。]
7.【题型一】丙酮的碘代反应$CH_3COCH_3+I_2\longrightarrow CH_3COCH_2I+HI$的速率方程为$v=kc^m(CH_3COCH_3)c^n(I_2)$,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为$\frac{0.7}{k}$。改变反应物浓度时,反应的瞬时速率如表所示。

下列说法正确的是 (
A.速率方程中的$m=0$、$n=1$
B.该反应的速率常数$k=2.8×10^{-3}\ \mathrm{min^{-1}}$
C.增大$I_2$的浓度,反应的瞬时速率加快
D.在过量的$I_2$存在时,反应掉87.5%的$CH_3COCH_3$所需的时间是375 min

下列说法正确的是 (
D
)A.速率方程中的$m=0$、$n=1$
B.该反应的速率常数$k=2.8×10^{-3}\ \mathrm{min^{-1}}$
C.增大$I_2$的浓度,反应的瞬时速率加快
D.在过量的$I_2$存在时,反应掉87.5%的$CH_3COCH_3$所需的时间是375 min
答案:
7.D[提示:A.由第一组数据和第二组数据可得$(\frac {0.25}{0.50})^m=\frac {1.4×10^{-3}}{2.8×10^{-3}}$,则m=1,由第二组数据和第四组数据可得$(\frac {0.050}{0.100})^n=\frac {2.8×10^{-3}}{2.8×10^{-3}}$,则n=0,A选项错误;
B.由A可知,m=1,n=0,则v=kc(CH₃COOH),带入第一组数据可得,k=5.6×10⁻³min⁻¹,B选项错误;C.由第二组和第四组数据分析可知,当其他条件不变时,增大I₂的浓度,反应的瞬时速率不变,C选项错误;D.存在过量的I₂时,反应掉87.5%CH₃COCH₃可以看作经历3个半衰期,即50%+25%+12.5%,因此所需的时间为$\frac {3×0.7}{5.6×10^{-3}}$min=375min,D选项正确。]
B.由A可知,m=1,n=0,则v=kc(CH₃COOH),带入第一组数据可得,k=5.6×10⁻³min⁻¹,B选项错误;C.由第二组和第四组数据分析可知,当其他条件不变时,增大I₂的浓度,反应的瞬时速率不变,C选项错误;D.存在过量的I₂时,反应掉87.5%CH₃COCH₃可以看作经历3个半衰期,即50%+25%+12.5%,因此所需的时间为$\frac {3×0.7}{5.6×10^{-3}}$min=375min,D选项正确。]
8.【题型一、二、三】(2025·河南省名校联盟月考)某科研团队研究纳米铁去除水样中$SeO_4^{2-}$的影响因素,相同温度下,设计了以下三组实验:
实验中测得不同条件下$SeO_4^{2-}$浓度随时间变化关系如下图。
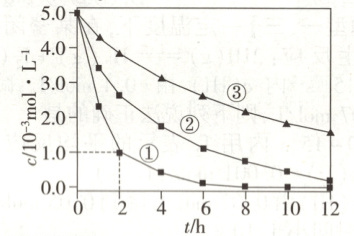
回答下列问题:
(1)实验①与②探究影响$SeO_4^{2-}$去除速率的影响因素是______。
(2)探究pH对$SeO_4^{2-}$去除速率影响的实验是______ (填序号),根据实验数据可以得出以下结论:其他条件相同时,______。
(3)完善实验①中化学反应的离子方程式:
\mathrm{Fe+SeO_4^{2-}+ _______$ Fe^{2+} + Se+ $_______}
(4)实验①,0~2 h内$SeO_4^{2-}$平均反应速率为______$\mathrm{mol/(L· h)}$。
(5)研究发现纳米铁粉(颗粒直径为纳米级)处理氧化废水的速率明显高于普通铁粉(颗粒直径为微米级),原因是______ 。
(6)纳米铁粉掺杂少量纳米碳可提高去除速率,原因是形成了原电池,纳米铁为电池的______极,纳米铁电极的电极反应式为______。
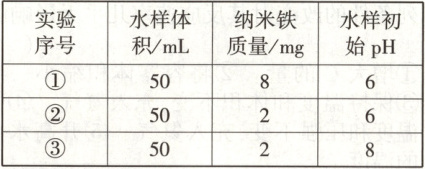
实验中测得不同条件下$SeO_4^{2-}$浓度随时间变化关系如下图。

回答下列问题:
(1)实验①与②探究影响$SeO_4^{2-}$去除速率的影响因素是______。
(2)探究pH对$SeO_4^{2-}$去除速率影响的实验是______ (填序号),根据实验数据可以得出以下结论:其他条件相同时,______。
(3)完善实验①中化学反应的离子方程式:
\mathrm{Fe+SeO_4^{2-}+ _______$ Fe^{2+} + Se+ $_______}
(4)实验①,0~2 h内$SeO_4^{2-}$平均反应速率为______$\mathrm{mol/(L· h)}$。
(5)研究发现纳米铁粉(颗粒直径为纳米级)处理氧化废水的速率明显高于普通铁粉(颗粒直径为微米级),原因是______ 。
(6)纳米铁粉掺杂少量纳米碳可提高去除速率,原因是形成了原电池,纳米铁为电池的______极,纳米铁电极的电极反应式为______。

答案:
8.
(1)纳米铁的质量
(2)②③ pH越小,SeO₄²⁻去除速率越快
(3)3 8H⁺ 3 1 4H₂O
(4)2×10⁻³
(5)纳米铁粉的颗粒小,接触面积大
(6)负 Fe-2e⁻=Fe²⁺[提示:
(1)实验①与②只有纳米铁的质量不一样,所以探究纳米铁的质量对SeO₄²⁻去除速率的影响。
(2)探究pH对SeO₄²⁻去除速率影响因素的实验是②和③,根据实验数据可以得出以下结论:其他条件相同时,pH越小,SeO₄²⁻去除速率越快。
(3)结合得失电子守恒,得实验①中化学反应的离子方程式为3Fe+SeO₄²⁻+8H⁺=3Fe²⁺+Se+4H₂O。
(4)结合图像,可得实验①中,0~2h内SeO₄²⁻平均反应速率为$\frac {5×10^{-3}mol·L^{-1}×10^{-3}mol·L^{-1}}{2h}$=2×10⁻³mol/(L·h)。研究发现纳米铁粉(颗粒直径为纳米级)处理氧化废水的速率明显高于普通铁粉(颗粒直径为微米级),可能是因为纳米铁粉的颗粒小,接触面积大。
(6)纳米铁粉掺杂少量纳米碳可提高去除速率,原因是形成了原电池,化学反应速率明显加快,纳米铁为电池的负极,电极反应式为Fe-2e⁻=Fe²⁺。]
(1)纳米铁的质量
(2)②③ pH越小,SeO₄²⁻去除速率越快
(3)3 8H⁺ 3 1 4H₂O
(4)2×10⁻³
(5)纳米铁粉的颗粒小,接触面积大
(6)负 Fe-2e⁻=Fe²⁺[提示:
(1)实验①与②只有纳米铁的质量不一样,所以探究纳米铁的质量对SeO₄²⁻去除速率的影响。
(2)探究pH对SeO₄²⁻去除速率影响因素的实验是②和③,根据实验数据可以得出以下结论:其他条件相同时,pH越小,SeO₄²⁻去除速率越快。
(3)结合得失电子守恒,得实验①中化学反应的离子方程式为3Fe+SeO₄²⁻+8H⁺=3Fe²⁺+Se+4H₂O。
(4)结合图像,可得实验①中,0~2h内SeO₄²⁻平均反应速率为$\frac {5×10^{-3}mol·L^{-1}×10^{-3}mol·L^{-1}}{2h}$=2×10⁻³mol/(L·h)。研究发现纳米铁粉(颗粒直径为纳米级)处理氧化废水的速率明显高于普通铁粉(颗粒直径为微米级),可能是因为纳米铁粉的颗粒小,接触面积大。
(6)纳米铁粉掺杂少量纳米碳可提高去除速率,原因是形成了原电池,化学反应速率明显加快,纳米铁为电池的负极,电极反应式为Fe-2e⁻=Fe²⁺。]
查看更多完整答案,请扫码查看


