2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
1.下列叙述正确的是 (
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥具有较强还原性的$\mathrm{HI}$、$\mathrm{H_2S}$等气体
B.浓硫酸与单质硫反应的化学方程式为$\mathrm{S+2H_2SO_4(浓)\xlongequal{\triangle}3SO_2\uparrow+2H_2O}$,在此反应中,浓硫酸既表现出强氧化性又表现出酸性
C.把足量铜粉投入含2 mol $\mathrm{H_2SO_4}$的浓硫酸中,得到气体的体积为22.4 L(标准状况下)
D.常温下能够用铁、铝容器盛放浓硫酸,是因为浓硫酸的强氧化性使铁、铝钝化
D
)A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥具有较强还原性的$\mathrm{HI}$、$\mathrm{H_2S}$等气体
B.浓硫酸与单质硫反应的化学方程式为$\mathrm{S+2H_2SO_4(浓)\xlongequal{\triangle}3SO_2\uparrow+2H_2O}$,在此反应中,浓硫酸既表现出强氧化性又表现出酸性
C.把足量铜粉投入含2 mol $\mathrm{H_2SO_4}$的浓硫酸中,得到气体的体积为22.4 L(标准状况下)
D.常温下能够用铁、铝容器盛放浓硫酸,是因为浓硫酸的强氧化性使铁、铝钝化
答案:
1.D[提示:A项,浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥具有还原性的气体和碱性气体(NH₃),错误;B项,浓硫酸与S、C等非金属单质反应时,由于没有盐生成,故没有表现出酸性,错误;C项,加热条件下,Cu与浓硫酸反应的过程中,浓硫酸的浓度逐渐降低,当降低到一定程度变为稀硫酸时,反应自动停止,故在标准状况下产生的SO₂的体积不足22.4L,错误;D项,常温下浓硫酸的强氧化性能够使铁、铝钝化,故能够用铁、铝容器盛放浓硫酸,正确。]
2.将过量的金属锌投入热浓硫酸中,下列判断正确的是
(
A.金属锌表面因生成致密氧化膜而不反应
B.会立即生成$\mathrm{H_2}$
C.会立即生成$\mathrm{SO_2}$,且只生成$\mathrm{SO_2}$
D.除了$\mathrm{SO_2}$外,还会有$\mathrm{H_2}$产生
(
D
)A.金属锌表面因生成致密氧化膜而不反应
B.会立即生成$\mathrm{H_2}$
C.会立即生成$\mathrm{SO_2}$,且只生成$\mathrm{SO_2}$
D.除了$\mathrm{SO_2}$外,还会有$\mathrm{H_2}$产生
答案:
2.D[提示:A.锌在浓硫酸中不发生钝化,A错。]
3.(2025·黑龙江哈三中模拟)浓硫酸分别和三种钠盐反应,现象如图所示。下列分析正确的是
(

A.①②③均为氧化还原反应
B.对比①和②可以说明还原性:$\mathrm{Br^->Cl^-}$
C.②中试管口白雾是$\mathrm{HCl}$遇水蒸气所致,说明酸性:$\mathrm{H_2SO_4>HCl}$
D.③中浓$\mathrm{H_2SO_4}$被还原成$\mathrm{SO_2}$
(
B
)
A.①②③均为氧化还原反应
B.对比①和②可以说明还原性:$\mathrm{Br^->Cl^-}$
C.②中试管口白雾是$\mathrm{HCl}$遇水蒸气所致,说明酸性:$\mathrm{H_2SO_4>HCl}$
D.③中浓$\mathrm{H_2SO_4}$被还原成$\mathrm{SO_2}$
答案:
3.B[提示:①生成的红棕色气体是溴蒸气,②白雾是氯化氢遇水蒸气所致,③生成的是二氧化硫气体,据此回答。A.①为氧化还原反应,②与③是非氧化还原反应,A错误;B.①生成的红棕色气体是溴蒸气,②白雾是氯化氢遇水蒸气产生的,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气,与同一种氧化剂在相同条件下反应,溴离子被氧化成溴单质,而氯离子不能被氧化,说明氧化性:Br⁻>Cl⁻,B正确;C.产生白雾是因为氯化氢易挥发,说明挥发性:H₂SO₄<HCl,C错误;D.③生成的是二氧化硫气体,为非氧化还原反应,是强酸制弱酸,D错误。故选B。]
4.(2025·北京育才学校月考)蔗糖与浓硫酸发生作用的过程如图所示。

下列关于该过程的分析不正确的是 (
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.该过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.该过程中蔗糖分子发生了化学键的断裂

下列关于该过程的分析不正确的是 (
C
)A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.该过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.该过程中蔗糖分子发生了化学键的断裂
答案:
4.C[提示:A.浓硫酸具有脱水性,能将有机物中的H原子和O原子按2:1的比例脱除,蔗糖中加入浓硫酸,白色固体变黑,体现浓硫酸的脱水性,A项正确;B.浓硫酸脱水过程中释放大量热,此时发生反应:C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O,$产生大量气体,使固体体积膨胀,B项正确;C.结合选项B可知,浓硫酸脱水过程中生成的SO₂能使品红溶液褪色,体现浓硫酸的强氧化性,C项错误;D.该过程中,蔗糖发生化学反应,发生了化学键的断裂,D项正确。故选C。]
5.某同学设想用图示装置来验证浓硫酸的某些性质,其中不能达到实验目的的是 (
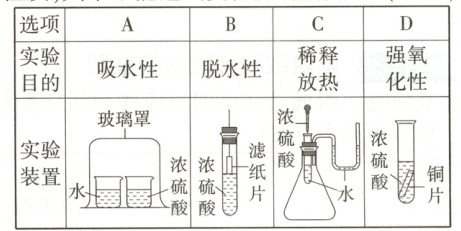
D
)
答案:
5.D[提示:A项由于分子是在不断运动着的,故玻璃罩内空气中的水蒸气不断地被浓硫酸吸收,导致左侧烧杯中的水不断挥发,最后左侧烧杯内的液体量明显少于右侧烧杯内的液体量,能达到实验目的;B项中滤纸片接触浓硫酸后,很快会因脱水而变黑,能达到实验目的;C项中浓硫酸滴到小试管内的水中,放出的热量会使锥形瓶内气体压强增大,U形管内液面出现左低右高的现象,能达到实验目的;D项因常温下铜片与浓硫酸不反应,无法判断浓硫酸是否有强氧化性,不能达到实验目的。]
6.探究铜和浓硫酸的反应,下列装置或操作错误的是
(
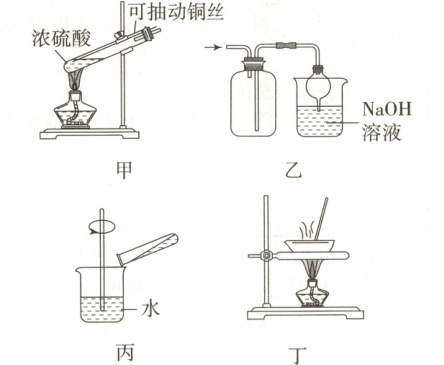
A.上下移动装置甲中的铜丝可控制生成$\mathrm{SO_2}$的量
B.装置乙可用于收集$\mathrm{SO_2}$气体
C.为确认甲中有$\mathrm{CuSO_4}$生成,将试管中的液体倒入装置丙中稀释,观察颜色
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出$\mathrm{CuSO_4·5H_2O}$
(
B
)
A.上下移动装置甲中的铜丝可控制生成$\mathrm{SO_2}$的量
B.装置乙可用于收集$\mathrm{SO_2}$气体
C.为确认甲中有$\mathrm{CuSO_4}$生成,将试管中的液体倒入装置丙中稀释,观察颜色
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出$\mathrm{CuSO_4·5H_2O}$
答案:
6.B[提示:可控制铜丝与溶液的接触面积来控制生成SO₂的量,故A不符合题意;二氧化硫的密度比空气的大,因此用装置乙收集二氧化硫时,应长进短出,故B符合题意;将试管中的液体倒入烧杯中,若变蓝,则有硫酸铜生成,故C不符合题意;利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出硫酸铜晶体,故D不符合题意。]
7.为了探究木炭与浓$\mathrm{H_2SO_4}$反应的产物中是否存在$\mathrm{CO_2}$,某同学选用下图所示装置进行实验:

(1)仪器a的名称为
(2)写出A中发生反应的化学方程式:
(3)装置B的作用是
(4)已知$\mathrm{SO_2}$也可以使澄清的石灰水变浑浊,则能说明产物中一定存在$\mathrm{CO_2}$气体的实验现象为

(1)仪器a的名称为
分液漏斗
;在组装好上述实验装置后,在装入药品之前必须进行的实验操作是检查装置的气密性
。(2)写出A中发生反应的化学方程式:
C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O$
。(3)装置B的作用是
吸收SO₂
;该装置中发生的化学反应可说明$\mathrm{SO_2}$具有还原
性。(4)已知$\mathrm{SO_2}$也可以使澄清的石灰水变浑浊,则能说明产物中一定存在$\mathrm{CO_2}$气体的实验现象为
C中品红溶液不褪色,D中澄清石灰水变浑浊
。
答案:
7.
(1)分液漏斗 检查装置的气密性
(2)C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O (3)$吸收SO₂ 还原
(4)C中品红溶液不褪色,D中澄清石灰水变浑浊
(1)分液漏斗 检查装置的气密性
(2)C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O (3)$吸收SO₂ 还原
(4)C中品红溶液不褪色,D中澄清石灰水变浑浊
查看更多完整答案,请扫码查看


