2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
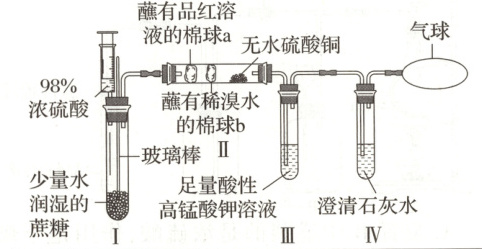
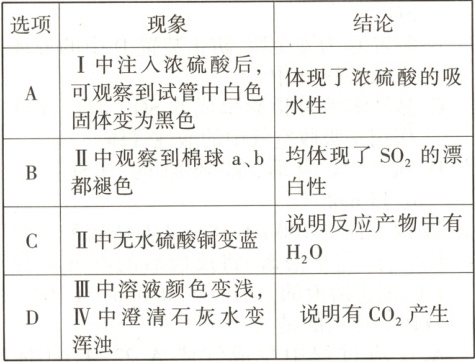
7.【题型一】某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中,正确的是 (
D
)

答案:
7.D[提示:A.蔗糖遇到浓硫酸变黑,是由于浓硫酸具有脱水性,将蔗糖中氢原子和氧原子按水的比例脱出,不是吸水性,故A错误;B.a棉球褪色,体现二氧化硫的漂白性,b棉球褪色,体现二氧化硫的还原性,故B错误;C.无水硫酸铜变蓝,证明有水,但是蘸有品红溶液和稀溴水的棉球中都有水,不能确定使无水硫酸铜变蓝的水是否由反应产生,故C错误;D.Ⅲ中溶液颜色变浅,是因为有二氧化硫,不褪色说明二氧化硫反应完全了,Ⅳ中澄清石灰水变浑浊,说明产生了二氧化碳气体,故D正确。]
8.【题型一、二】已知锌跟浓硫酸反应生成$\mathrm{SO_2}$,跟稀硫酸反应生成$\mathrm{H_2}$。使一定量的锌与100 mL 18.5 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A 33.6 L。将反应后的溶液稀释到1 L,测得溶液中氢离子的浓度为0.1 mol/L。
(1)写出锌跟浓硫酸反应的化学方程式:
(2)反应过程中消耗的$\mathrm{H_2SO_4}$的物质的量是
(3)气体A的成分是
(4)反应过程中消耗的锌的质量是
(1)写出锌跟浓硫酸反应的化学方程式:
Zn+2H₂SO₄(浓$)\overset{\triangle}{=}ZnSO₄+SO₂↑+2H₂O$
。(2)反应过程中消耗的$\mathrm{H_2SO_4}$的物质的量是
1.8mol
。(3)气体A的成分是
二氧化硫和氢气
,气体成分的体积比是V(SO₂):V(H₂)=1:4
。(4)反应过程中消耗的锌的质量是
97.5g
。
答案:
8.
(1)Zn+2H₂SO₄(浓$)\overset{\triangle}{=}ZnSO₄+SO₂↑+2H₂O (2)1.8mol (3)$二氧化硫和氢气V(SO₂):V(H₂)=1:4
(4)97.5g
(1)Zn+2H₂SO₄(浓$)\overset{\triangle}{=}ZnSO₄+SO₂↑+2H₂O (2)1.8mol (3)$二氧化硫和氢气V(SO₂):V(H₂)=1:4
(4)97.5g
9.【题型一、二】某工厂的工业废水中含有大量的$\mathrm{Al_2(SO_4)_3}$、较多的$\mathrm{Cu^{2+}}$和少量的$\mathrm{Na^+}$。从工业废水中回收金属铝和金属铜的工艺流程如下图所示(试剂X、Y、Z均过量)。
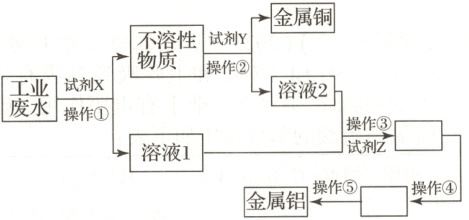
(1)试剂X为
(2)操作②为
(3)溶液2中含有的溶质有
(4)写出操作④的化学反应方程式:
(5)金属铜能与浓硫酸在加热的条件下发生反应,产生的气体为

(1)试剂X为
铝
,加入试剂X发生反应的离子方程式是$2Al+3Cu²⁺\overset{\triangle}{=}2Al³⁺+3Cu$
,试剂Z为氨水
。(2)操作②为
过滤
(填实验分离方法)。(3)溶液2中含有的溶质有
Al₂(SO₄)₃、H₂SO₄
(填化学式)。(4)写出操作④的化学反应方程式:
$2Al(OH)₃\overset{\triangle}{=}Al₂O₃+3H₂O$
。(5)金属铜能与浓硫酸在加热的条件下发生反应,产生的气体为
SO₂
(填化学式)。
答案:
9.
(1)铝$ 2Al+3Cu²⁺\overset{\triangle}{=}2Al³⁺+3Cu $氨水
(2)过滤
(3)Al₂(SO₄)₃、$H₂SO₄ (4)2Al(OH)₃\overset{\triangle}{=}Al₂O₃+3H₂O (5)SO₂$
(1)铝$ 2Al+3Cu²⁺\overset{\triangle}{=}2Al³⁺+3Cu $氨水
(2)过滤
(3)Al₂(SO₄)₃、$H₂SO₄ (4)2Al(OH)₃\overset{\triangle}{=}Al₂O₃+3H₂O (5)SO₂$
10.【题型一、二】为测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应设计了图示实验装置。
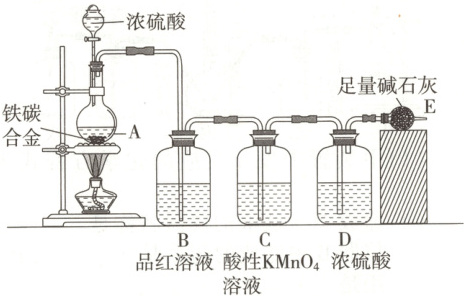
(1)在装药品前要进行的操作是
(2)a克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A中无明显现象,其原因是常温下:
①
②
(3)写出加热时A中碳与浓硫酸发生反应的化学方程式:
(4)B中的现象是
C的作用是
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为
(6)经测定,(5)中测得结果偏小,原因可能是什么?

(1)在装药品前要进行的操作是
检查装置气密性
。(2)a克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A中无明显现象,其原因是常温下:
①
碳与浓硫酸不反应
;②
铁与浓硫酸发生钝化现象
。(3)写出加热时A中碳与浓硫酸发生反应的化学方程式:
C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O$
。(4)B中的现象是
品红溶液褪色(或颜色变浅)
;C的作用是
除尽反应产物中的SO₂气体
。(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为
$\frac{11a - 3b}{11a}×100%$
(写含a、b的表达式)。(6)经测定,(5)中测得结果偏小,原因可能是什么?
答案:
10.
(1)检查装置气密性
(2)①碳与浓硫酸不反应 ②铁与浓硫酸发生钝化现象
(3)C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O (4)$品红溶液褪色(或颜色变浅) 除尽反应产物中的SO₂气体$ (5)\frac{11a - 3b}{11a}×100% (6)SO₂$未除尽,与E中碱石灰反应导致E增重偏大,故测定结果偏小(合理即可)
(1)检查装置气密性
(2)①碳与浓硫酸不反应 ②铁与浓硫酸发生钝化现象
(3)C+2H₂SO₄(浓$)\overset{\triangle}{=}CO₂↑+2SO₂↑+2H₂O (4)$品红溶液褪色(或颜色变浅) 除尽反应产物中的SO₂气体$ (5)\frac{11a - 3b}{11a}×100% (6)SO₂$未除尽,与E中碱石灰反应导致E增重偏大,故测定结果偏小(合理即可)
查看更多完整答案,请扫码查看


