2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
8.【题型四】向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)$\rightleftharpoons $3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol/L。下列说法中正确的是
(
A.用物质A表示该反应的平均速率为0.2 mol/(L·s)
B.用物质B表示该反应的平均速率为0.2 mol/(L·s)
C.平衡时物质A的转化率是B的转化率的2倍
D.平衡时物质B的浓度为0.2 mol/L
(
A
)A.用物质A表示该反应的平均速率为0.2 mol/(L·s)
B.用物质B表示该反应的平均速率为0.2 mol/(L·s)
C.平衡时物质A的转化率是B的转化率的2倍
D.平衡时物质B的浓度为0.2 mol/L
答案:
8.A[提示:A.$\mathrm{C}$的浓度变化为$0.6\ \mathrm{mol/L}$,$v(\mathrm{C})=\frac{\Delta c\ 0.6\ \mathrm{mol· L^{-1}}}{\Delta t\ 2\ \mathrm{s}}=0.3\ \mathrm{mol/(L· s)}$,化学反应速率之比等于化学计量数之比,所以$v(\mathrm{A})=\frac{2}{3}v(\mathrm{C})=0.2\ \mathrm{mol/(L· s)}$,故A正确;B.由A选项知,$v(\mathrm{C})=0.3\ \mathrm{mol/(L· s)}$,化学反应速率之比等于化学计量数之比,$v(\mathrm{B})=\frac{1}{3}v(\mathrm{C})=0.1\ \mathrm{mol/(L· s)}$,故B错误;C.A、B化学计量数之比为$2:1$,参加反应的A、B的物质的量之比为$2:1$,A、B的起始物质的量之比为$2:1$,平衡时物质A与B的转化率相等,故C错误;D.$\Delta c(\mathrm{C})=0.6\ \mathrm{mol/L}$,根据$2\mathrm{A(g)}+\mathrm{B(g)}\rightleftharpoons3\mathrm{C(g)}$可知,$\Delta c(\mathrm{B})=\frac{1}{3}\Delta c(\mathrm{C})=\frac{1}{3}×0.6\ \mathrm{mol/L}=0.2\ \mathrm{mol/L}$,所以B的平衡浓度为$\frac{1}{2}\mathrm{L}-0.2\ \mathrm{mol/L}=0.3\ \mathrm{mol/L}$,故D错误。]
9.【题型四】将0.10 mol $\mathrm{CO_2}$与0.40 mol $\mathrm{H_2S}$充入2.5 L的恒容密闭容器中,高温下发生反应:$\mathrm{H_2S(g)}$+$\mathrm{CO_2(g)}$$\rightleftharpoons $$\mathrm{COS(g)}$+$\mathrm{H_2O(g)}$,4 s后反应达到平衡,此时水的物质的量分数为2%,下列描述不正确的是
(
A.平衡时$\mathrm{H_2O}$的质量分数为2%
B.这4 s内$\mathrm{CO_2}$的平均反应速率为0.001 mol/(L·s)
C.平衡时COS的浓度为0.004 mol/L
D.$\mathrm{H_2S}$的平衡转化率为2.5%
(
A
)A.平衡时$\mathrm{H_2O}$的质量分数为2%
B.这4 s内$\mathrm{CO_2}$的平均反应速率为0.001 mol/(L·s)
C.平衡时COS的浓度为0.004 mol/L
D.$\mathrm{H_2S}$的平衡转化率为2.5%
答案:
9.A[提示:按“三段式”求解。设达到平衡时,生成$\mathrm{H_{2}O}$的物质的量为$x\ \mathrm{mol}$,
$\mathrm{H_{2}S(g)}+\mathrm{CO_{2}(g)}\rightleftharpoons\mathrm{COS(g)}+\mathrm{H_{2}O(g)}$
起始量/mol 0.40 0.10 0 0
转化量/mol $x$ $x$ $x$ $x$
4s后/mol $0.40 - x$ $0.10 - x$ $x$ $x$
根据题意可列式为:$x÷(0.40 - x + 0.10 - x + x + x)=0.02$,解得$x = 0.01$,则平衡时$\mathrm{H_{2}O}$的质量分数为$0.01\ \mathrm{mol}×18\ \mathrm{g/mol}÷(0.09\ \mathrm{mol}×44\ \mathrm{g/mol}+0.39\ \mathrm{mol}×34\ \mathrm{g/mol}+0.01\ \mathrm{mol}×60\ \mathrm{g/mol}+0.01\ \mathrm{mol}×18\ \mathrm{g/mol})×100\% = 1\%$,A项错误;这4s内,$v(\mathrm{CO_{2}})=\frac{0.01\ \mathrm{mol}}{2.5\ \mathrm{L}×4\ \mathrm{s}}=0.001\ \mathrm{mol/(L· s)}$,B项正确;平衡时$\mathrm{COS}$的浓度为$\frac{0.01\ \mathrm{mol}}{2.5\ \mathrm{L}}=0.004\ \mathrm{mol/L}$,C项正确;$\mathrm{H_{2}S}$的平衡转化率为$\frac{0.01\ \mathrm{mol}}{0.40\ \mathrm{mol}}×100\% = 2.5\%$,D项正确。]
$\mathrm{H_{2}S(g)}+\mathrm{CO_{2}(g)}\rightleftharpoons\mathrm{COS(g)}+\mathrm{H_{2}O(g)}$
起始量/mol 0.40 0.10 0 0
转化量/mol $x$ $x$ $x$ $x$
4s后/mol $0.40 - x$ $0.10 - x$ $x$ $x$
根据题意可列式为:$x÷(0.40 - x + 0.10 - x + x + x)=0.02$,解得$x = 0.01$,则平衡时$\mathrm{H_{2}O}$的质量分数为$0.01\ \mathrm{mol}×18\ \mathrm{g/mol}÷(0.09\ \mathrm{mol}×44\ \mathrm{g/mol}+0.39\ \mathrm{mol}×34\ \mathrm{g/mol}+0.01\ \mathrm{mol}×60\ \mathrm{g/mol}+0.01\ \mathrm{mol}×18\ \mathrm{g/mol})×100\% = 1\%$,A项错误;这4s内,$v(\mathrm{CO_{2}})=\frac{0.01\ \mathrm{mol}}{2.5\ \mathrm{L}×4\ \mathrm{s}}=0.001\ \mathrm{mol/(L· s)}$,B项正确;平衡时$\mathrm{COS}$的浓度为$\frac{0.01\ \mathrm{mol}}{2.5\ \mathrm{L}}=0.004\ \mathrm{mol/L}$,C项正确;$\mathrm{H_{2}S}$的平衡转化率为$\frac{0.01\ \mathrm{mol}}{0.40\ \mathrm{mol}}×100\% = 2.5\%$,D项正确。]
10.【题型一、二、四】Ⅰ.某温度时,在一个10 L的恒容容器中:X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:

(1)该反应的化学方程式为______;
(2)反应开始至2 min,以气体Z表示的平均反应速率为______;
(3)平衡时容器内混合气体密度比起始时_______(填“变大”“变小”或“相等”),混合气体的平均相对分子质量比起始时_______;
(4)若a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=2n(Z),
则原混合气体中a:b=_______。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色 ⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明$\mathrm{I_2(g)}$+$\mathrm{H_2(g)}$$\rightleftharpoons $2$\mathrm{HI(g)}$达到平衡状态的是 ;
(2)一定能证明A(s)+2B(g)$\rightleftharpoons $C(g)+D(g)达到平衡状态的是 。

(1)该反应的化学方程式为______;
(2)反应开始至2 min,以气体Z表示的平均反应速率为______;
(3)平衡时容器内混合气体密度比起始时_______(填“变大”“变小”或“相等”),混合气体的平均相对分子质量比起始时_______;
(4)若a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的物质的量恰好满足:n(X)=n(Y)=2n(Z),
则原混合气体中a:b=_______。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色 ⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明$\mathrm{I_2(g)}$+$\mathrm{H_2(g)}$$\rightleftharpoons $2$\mathrm{HI(g)}$达到平衡状态的是 ;
(2)一定能证明A(s)+2B(g)$\rightleftharpoons $C(g)+D(g)达到平衡状态的是 。
答案:
10.Ⅰ.
(1)$3\mathrm{X(g)}+\mathrm{Y(g)}\rightleftharpoons2\mathrm{Z(g)}$
(2)$0.01\ \mathrm{mol/(L· min)}$
(3)相等 变大
(4)7:5 Ⅱ.
(1)⑤
(2)②④[提示:Ⅰ.
(4)
$\begin{matrix} &3\mathrm{X(g)}& +& \mathrm{Y(g)} &\rightleftharpoons &2\mathrm{Z(g)} \ ( 设Y的变化量是x\ \mathrm{mol})\\ 初始量(mol) &a & &b & &0 \\ 变化量(mol) &3x & &x & &2x \\ 某时刻量(mol) &a - 3x & &b - x & &2x \end{matrix}$
当$n(\mathrm{X}) = n(\mathrm{Y}) = 2n(\mathrm{Z})$时,$a - 3x = b - x = 4x$,则$a = 7x$,$b = 5x$,所以$a:b = 7:5$。Ⅱ.
(1)①反应前后气体化学计量数之和相等,因此压强不变,不能说明反应达到平衡状态,故①错误;②各组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡状态,故②错误;③反应前后气体化学计量数之和相等,因此物质的量不变,不能说明反应达到平衡状态,故③错误;④根据$\overline{M}=\frac{m}{n}$,各组分都是气体,气体质量不变,气体总物质的量不变,因此当$\overline{M}$不变,不能说明反应达到平衡状态,故④错误;⑤$\mathrm{I_{2}}$是有颜色的气体,因此颜色不变,说明反应达到平衡状态,故⑤正确;⑥没有指明反应进行的方向,故⑥错误。
(2)①反应前后气体化学计量数之和相等,因此压强不变,不能说明反应达到平衡状态,故①错误;②A为固体,其余的组分都是气体,未平衡时气体质量是变化的,是恒容状态,容器的体积不变,因此当密度不变,说明反应达到平衡状态,故②正确;③反应前后气体物质的量不变,因此总物质的量不变,不能说明反应达到平衡状态,故③错误;④根据$\overline{M}=\frac{m}{n}$,未平衡时气体质量是变化的,气体物质的量不变,因此当$\overline{M}$不变,能说明反应达到平衡状态,故④正确;⑤题目中没有说明气体的颜色,因此颜色不变不能说明反应达到平衡状态,故⑤错误;⑥没有指明反应进行的方向,故⑥错误。]
(1)$3\mathrm{X(g)}+\mathrm{Y(g)}\rightleftharpoons2\mathrm{Z(g)}$
(2)$0.01\ \mathrm{mol/(L· min)}$
(3)相等 变大
(4)7:5 Ⅱ.
(1)⑤
(2)②④[提示:Ⅰ.
(4)
$\begin{matrix} &3\mathrm{X(g)}& +& \mathrm{Y(g)} &\rightleftharpoons &2\mathrm{Z(g)} \ ( 设Y的变化量是x\ \mathrm{mol})\\ 初始量(mol) &a & &b & &0 \\ 变化量(mol) &3x & &x & &2x \\ 某时刻量(mol) &a - 3x & &b - x & &2x \end{matrix}$
当$n(\mathrm{X}) = n(\mathrm{Y}) = 2n(\mathrm{Z})$时,$a - 3x = b - x = 4x$,则$a = 7x$,$b = 5x$,所以$a:b = 7:5$。Ⅱ.
(1)①反应前后气体化学计量数之和相等,因此压强不变,不能说明反应达到平衡状态,故①错误;②各组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡状态,故②错误;③反应前后气体化学计量数之和相等,因此物质的量不变,不能说明反应达到平衡状态,故③错误;④根据$\overline{M}=\frac{m}{n}$,各组分都是气体,气体质量不变,气体总物质的量不变,因此当$\overline{M}$不变,不能说明反应达到平衡状态,故④错误;⑤$\mathrm{I_{2}}$是有颜色的气体,因此颜色不变,说明反应达到平衡状态,故⑤正确;⑥没有指明反应进行的方向,故⑥错误。
(2)①反应前后气体化学计量数之和相等,因此压强不变,不能说明反应达到平衡状态,故①错误;②A为固体,其余的组分都是气体,未平衡时气体质量是变化的,是恒容状态,容器的体积不变,因此当密度不变,说明反应达到平衡状态,故②正确;③反应前后气体物质的量不变,因此总物质的量不变,不能说明反应达到平衡状态,故③错误;④根据$\overline{M}=\frac{m}{n}$,未平衡时气体质量是变化的,气体物质的量不变,因此当$\overline{M}$不变,能说明反应达到平衡状态,故④正确;⑤题目中没有说明气体的颜色,因此颜色不变不能说明反应达到平衡状态,故⑤错误;⑥没有指明反应进行的方向,故⑥错误。]
11.【题型二、三】在2 L恒容密闭容器中,800 ℃时,反应2$\mathrm{NO(g)}$+$\mathrm{O_2(g)}$$\rightleftharpoons $2$\mathrm{NO_2(g)}$体系中,n(NO)随时间的变化如下表所示。


(1)上图中,A点处$v_正$$v_逆$(填“大于”“小于”或“等于”)。
(2)图中表示$\mathrm{NO_2}$变化的曲线是。用$\mathrm{O_2}$表示从0~2 s内该反应的平均速率$v$=。
(3)下列能说明该反应已经达到平衡状态的是(填字母,下同)。
a.$v(\mathrm{NO_2})$=2$v(\mathrm{O_2})$
b.容器内压强保持不变
c.$v_逆(\mathrm{NO})$=2$v_正(\mathrm{O_2})$
d.容器内的气体密度保持不变
(4)下列能使该反应的反应速率增大的是。
a.及时分离出$\mathrm{NO_2}$气体
b.适当升高温度
c.增大$\mathrm{O_2}$的浓度
d.选择高效的催化剂


(1)上图中,A点处$v_正$$v_逆$(填“大于”“小于”或“等于”)。
(2)图中表示$\mathrm{NO_2}$变化的曲线是。用$\mathrm{O_2}$表示从0~2 s内该反应的平均速率$v$=。
(3)下列能说明该反应已经达到平衡状态的是(填字母,下同)。
a.$v(\mathrm{NO_2})$=2$v(\mathrm{O_2})$
b.容器内压强保持不变
c.$v_逆(\mathrm{NO})$=2$v_正(\mathrm{O_2})$
d.容器内的气体密度保持不变
(4)下列能使该反应的反应速率增大的是。
a.及时分离出$\mathrm{NO_2}$气体
b.适当升高温度
c.增大$\mathrm{O_2}$的浓度
d.选择高效的催化剂
答案:
11.
(1)大于
(2)$b$ $1.5×10^{-3}\ \mathrm{mol/(L· s)}$
(3)bc
(4)bcd[提示:
(1)图中表明A点的反应时间小于$1\ \mathrm{s}$,表中表明在$0\sim1\ \mathrm{s}$内$n(\mathrm{NO})$呈减小趋势,则反应$2\mathrm{NO(g)}+\mathrm{O_{2}(g)}\rightleftharpoons2\mathrm{NO_{2}(g)}$在向右进行,$v_{正}>v_{逆}$。
(2)反应向右进行,则$c(\mathrm{NO})$由逐渐减小到保持不变。表中表明,反应从开始到平衡,$n(\mathrm{NO})$减小$0.020\ \mathrm{mol}-0.007\ \mathrm{mol}=0.013\ \mathrm{mol}$,则$n(\mathrm{NO_{2}})$增加$0.013\ \mathrm{mol}$。反应容器的容积为$2\ \mathrm{L}$,则平衡时$c(\mathrm{NO_{2}})$为$0.0065\ \mathrm{mol/L}$,则表示$\mathrm{NO_{2}}$变化的曲线是$b$。表中表明,在$0\sim2\ \mathrm{s}$内$n(\mathrm{NO})$减小$0.020\ \mathrm{mol}-0.008\ \mathrm{mol}=0.012\ \mathrm{mol}$,则$n(\mathrm{O_{2}})$减小$0.006\ \mathrm{mol}$,容器容积为$2\ \mathrm{L}$,则$c(\mathrm{O_{2}})$减小$0.003\ \mathrm{mol/L}$,反应时间为$2\ \mathrm{s}$,根据$v=\frac{\Delta c}{\Delta t}$计算得$v(\mathrm{O_{2}})=1.5×10^{-3}\ \mathrm{mol/(L· s)}$。
(3)化学平衡状态中正、逆反应速率相等,$v_{正}(\mathrm{NO_{2}})=2v_{逆}(\mathrm{O_{2}})$体现了反应中正、逆反应速率相等,$v(\mathrm{NO_{2}})=2v(\mathrm{O_{2}})$不能说明反应已达平衡状态。题述反应,在达到平衡之前气体总物质的量变化,则在恒温、恒容下气体总压强变化,在达到平衡之后气体总物质的量不变,则在恒温、恒容下气体总压强不变,说明反应已经达到平衡。题述反应,在达到平衡前后气体质量守恒,由于容器容积不变,则容器内的密度不变不能说明反应达到平衡。
(4)其他条件一定,升高温度或增大反应物的浓度或使用催化剂,都能使化学反应速率增大;反之,可使化学反应速率减小。]
(1)大于
(2)$b$ $1.5×10^{-3}\ \mathrm{mol/(L· s)}$
(3)bc
(4)bcd[提示:
(1)图中表明A点的反应时间小于$1\ \mathrm{s}$,表中表明在$0\sim1\ \mathrm{s}$内$n(\mathrm{NO})$呈减小趋势,则反应$2\mathrm{NO(g)}+\mathrm{O_{2}(g)}\rightleftharpoons2\mathrm{NO_{2}(g)}$在向右进行,$v_{正}>v_{逆}$。
(2)反应向右进行,则$c(\mathrm{NO})$由逐渐减小到保持不变。表中表明,反应从开始到平衡,$n(\mathrm{NO})$减小$0.020\ \mathrm{mol}-0.007\ \mathrm{mol}=0.013\ \mathrm{mol}$,则$n(\mathrm{NO_{2}})$增加$0.013\ \mathrm{mol}$。反应容器的容积为$2\ \mathrm{L}$,则平衡时$c(\mathrm{NO_{2}})$为$0.0065\ \mathrm{mol/L}$,则表示$\mathrm{NO_{2}}$变化的曲线是$b$。表中表明,在$0\sim2\ \mathrm{s}$内$n(\mathrm{NO})$减小$0.020\ \mathrm{mol}-0.008\ \mathrm{mol}=0.012\ \mathrm{mol}$,则$n(\mathrm{O_{2}})$减小$0.006\ \mathrm{mol}$,容器容积为$2\ \mathrm{L}$,则$c(\mathrm{O_{2}})$减小$0.003\ \mathrm{mol/L}$,反应时间为$2\ \mathrm{s}$,根据$v=\frac{\Delta c}{\Delta t}$计算得$v(\mathrm{O_{2}})=1.5×10^{-3}\ \mathrm{mol/(L· s)}$。
(3)化学平衡状态中正、逆反应速率相等,$v_{正}(\mathrm{NO_{2}})=2v_{逆}(\mathrm{O_{2}})$体现了反应中正、逆反应速率相等,$v(\mathrm{NO_{2}})=2v(\mathrm{O_{2}})$不能说明反应已达平衡状态。题述反应,在达到平衡之前气体总物质的量变化,则在恒温、恒容下气体总压强变化,在达到平衡之后气体总物质的量不变,则在恒温、恒容下气体总压强不变,说明反应已经达到平衡。题述反应,在达到平衡前后气体质量守恒,由于容器容积不变,则容器内的密度不变不能说明反应达到平衡。
(4)其他条件一定,升高温度或增大反应物的浓度或使用催化剂,都能使化学反应速率增大;反之,可使化学反应速率减小。]
12.【题型二、四】(2025·河南省名校大联考)$\mathrm{NO_x}$是空气污染物,烟气脱硝是环境保护、促进社会可持续发展的重要课题。
(1)甲烷还原法。
高温条件下$\mathrm{CH_4}$能将$\mathrm{NO_2}$转化为无害气体,反应的化学方程式为 。
(2)$\mathrm{H_2}$催化还原法。
发生反应:2$\mathrm{NO(g)}$+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$。
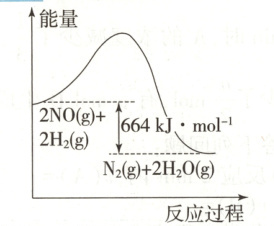
①反应过程中的能量变化如图所示,已知破坏1 mol $\mathrm{H—H}$键、1 mol $\mathrm{H—O}$键、1 mol $\mathrm{N≡N}$键时分别需要吸收436 kJ、463 kJ、946 kJ的能量,则破坏1 mol NO分子中化学键需要吸收 kJ的能量。
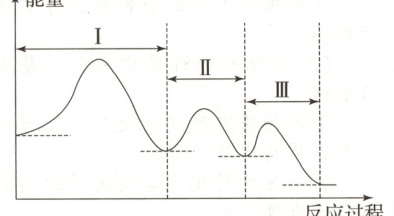
②$\mathrm{H_2}$还原NO的反应分三步完成,第Ⅰ步:2$\mathrm{NO(g)}$$\rightleftharpoons $$\mathrm{N_2O_2(g)}$,第Ⅱ步:$\mathrm{N_2O_2(g)}$+$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2O(g)}$+$\mathrm{H_2O(g)}$,反应过程如图所示。则第Ⅲ步反应的化学方程式为 ,已知断开反应物中的化学键吸收的能量越多,反应越难进行,则总反应的反应速率取决于第 步(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
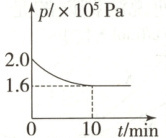
③一定条件下,将0.6 mol NO和0.8 mol $\mathrm{H_2}$充入10 L恒容密闭容器中发生反应:2NO(g)+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$,容器内压强随时间的变化关系如图所示。0~10 min内,$v(\mathrm{N_2})$=
mol/(L·min)。某同学认为为在该条件下,只要反应足够长时间,n(NO)可变为0,请你分析他的观点错误的原因:。
④下列叙述能说明反应2$\mathrm{NO(g)}$+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$,在恒温恒容密闭容器中达到平衡状态的是(填标号)。
A.$v(\mathrm{NO})$=2$v(\mathrm{N_2})$
B.混合气体中NO的物质的量分数不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(1)甲烷还原法。
高温条件下$\mathrm{CH_4}$能将$\mathrm{NO_2}$转化为无害气体,反应的化学方程式为 。
(2)$\mathrm{H_2}$催化还原法。
发生反应:2$\mathrm{NO(g)}$+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$。
①反应过程中的能量变化如图所示,已知破坏1 mol $\mathrm{H—H}$键、1 mol $\mathrm{H—O}$键、1 mol $\mathrm{N≡N}$键时分别需要吸收436 kJ、463 kJ、946 kJ的能量,则破坏1 mol NO分子中化学键需要吸收 kJ的能量。

②$\mathrm{H_2}$还原NO的反应分三步完成,第Ⅰ步:2$\mathrm{NO(g)}$$\rightleftharpoons $$\mathrm{N_2O_2(g)}$,第Ⅱ步:$\mathrm{N_2O_2(g)}$+$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2O(g)}$+$\mathrm{H_2O(g)}$,反应过程如图所示。则第Ⅲ步反应的化学方程式为 ,已知断开反应物中的化学键吸收的能量越多,反应越难进行,则总反应的反应速率取决于第 步(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

③一定条件下,将0.6 mol NO和0.8 mol $\mathrm{H_2}$充入10 L恒容密闭容器中发生反应:2NO(g)+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$,容器内压强随时间的变化关系如图所示。0~10 min内,$v(\mathrm{N_2})$=
mol/(L·min)。某同学认为为在该条件下,只要反应足够长时间,n(NO)可变为0,请你分析他的观点错误的原因:。

④下列叙述能说明反应2$\mathrm{NO(g)}$+2$\mathrm{H_2(g)}$$\rightleftharpoons $$\mathrm{N_2(g)}$+2$\mathrm{H_2O(g)}$,在恒温恒容密闭容器中达到平衡状态的是(填标号)。
A.$v(\mathrm{NO})$=2$v(\mathrm{N_2})$
B.混合气体中NO的物质的量分数不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
答案:
12.
(1)$\mathrm{CH_{4}} + 2\mathrm{NO_{2}}\xrightleftharpoons[]{} \mathrm{N_{2}} + \mathrm{CO_{2}} + 2\mathrm{H_{2}O}$
(2)①631 ②$\mathrm{N_{2}O(g)} + \mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + \mathrm{H_{2}O(g)}$ Ⅰ ③$2.8×10^{-3}$ 可逆反应中反应物的转化率不可能达$100\%$(合理即可) ④BD[提示:
(1)高温条件下$\mathrm{CH_{4}}$能将$\mathrm{NO_{2}}$转化为无害气体,可知反应生成二氧化碳、氮气和水,配平后可得反应的化学方程式为:$\mathrm{CH_{4}} + 2\mathrm{NO_{2}}\xrightleftharpoons[高温]{} \mathrm{N_{2}} + \mathrm{CO_{2}} + 2\mathrm{H_{2}O}$。
(2) ①根据图示,$2\ \mathrm{mol}\ \mathrm{NO}$发生反应:$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$,放热$664\ \mathrm{kJ}$,设破坏$1\ \mathrm{mol}\ \mathrm{NO}$分子中化学键需要吸收$x\ \mathrm{kJ}$的能量,则:$946 + 463×4 - 2x - 436×2 = 664$,$x = 631$,所以破坏$1\ \mathrm{mol}\ \mathrm{NO}$分子中化学键需要吸收$631\ \mathrm{kJ}$的能量;②总反应$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$减去第Ⅰ步、第Ⅱ步反应可得第Ⅲ步反应的化学方程式:$\mathrm{N_{2}O(g)} + \mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + \mathrm{H_{2}O(g)}$,已知断开反应物中的化学键吸收的能量越多,反应越难进行,根据图示,第Ⅰ步反应断开反应物中的化学键吸收的能量最多,第Ⅰ步反应最难进行,则总反应的反应速率取决于第Ⅰ步;③一定条件下,将$0.6\ \mathrm{mol}\ \mathrm{NO}$和$0.8\ \mathrm{mol}\ \mathrm{H_{2}}$充入$10\ \mathrm{L}$恒容密闭容器中发生反应:$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$,恒温恒容时,物质的量之比等于其压强之比,则根据图示,$10\ \mathrm{min}$时,容器内气体总物质的量为$(0.6 + 0.8)\ \mathrm{mol}×\frac{1.6}{2.0}=1.12\ \mathrm{mol}$,即$0\sim10\ \mathrm{min}$内,容器内气体减少$(1.4 - 1.2)\ \mathrm{mol}=0.28\ \mathrm{mol}$,由反应式可知,每生成$1\ \mathrm{mol}\ \mathrm{N_{2}}$,混合气体减少$1\ \mathrm{mol}$,此时混合气体减少$0.28\ \mathrm{mol}$,则$0\sim10\ \mathrm{min}$内生成$0.28\ \mathrm{mol}\ \mathrm{N_{2}}$,所以$0\sim10\ \mathrm{min}$内,$v(\mathrm{N_{2}})=\frac{0.28\ \mathrm{mol}}{10\ \mathrm{L}×10\ \mathrm{min}}=2.8×10^{-3}\ \mathrm{mol/(L· min)}$。该反应为可逆反应,反应物的转化率不可能达$100\%$,无论反应多长时间,$n(\mathrm{NO})$不可能变为$0$;④由反应式可得:$v(\mathrm{NO}) = 2v(\mathrm{N_{2}})$,但并未体现同一组正、逆反应速率相等,不能说明反应达到平衡状态,A不符合题意;B.混合气体中$\mathrm{NO}$的物质的量分数不再改变,即$\mathrm{NO}$的浓度不再改变,能说明反应达到平衡状态,B符合题意;C.混合气体质量不变,容器体积不变,混合气体密度始终不变,不能说明反应达到平衡状态,C不符合题意;D.该反应是气体分子数减小的反应,在恒温恒容密闭容器中,混合气体的压强在改变,则当混合气体的压强不再改变时,能说明反应达到平衡状态,D符合题意。]
(1)$\mathrm{CH_{4}} + 2\mathrm{NO_{2}}\xrightleftharpoons[]{} \mathrm{N_{2}} + \mathrm{CO_{2}} + 2\mathrm{H_{2}O}$
(2)①631 ②$\mathrm{N_{2}O(g)} + \mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + \mathrm{H_{2}O(g)}$ Ⅰ ③$2.8×10^{-3}$ 可逆反应中反应物的转化率不可能达$100\%$(合理即可) ④BD[提示:
(1)高温条件下$\mathrm{CH_{4}}$能将$\mathrm{NO_{2}}$转化为无害气体,可知反应生成二氧化碳、氮气和水,配平后可得反应的化学方程式为:$\mathrm{CH_{4}} + 2\mathrm{NO_{2}}\xrightleftharpoons[高温]{} \mathrm{N_{2}} + \mathrm{CO_{2}} + 2\mathrm{H_{2}O}$。
(2) ①根据图示,$2\ \mathrm{mol}\ \mathrm{NO}$发生反应:$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$,放热$664\ \mathrm{kJ}$,设破坏$1\ \mathrm{mol}\ \mathrm{NO}$分子中化学键需要吸收$x\ \mathrm{kJ}$的能量,则:$946 + 463×4 - 2x - 436×2 = 664$,$x = 631$,所以破坏$1\ \mathrm{mol}\ \mathrm{NO}$分子中化学键需要吸收$631\ \mathrm{kJ}$的能量;②总反应$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$减去第Ⅰ步、第Ⅱ步反应可得第Ⅲ步反应的化学方程式:$\mathrm{N_{2}O(g)} + \mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + \mathrm{H_{2}O(g)}$,已知断开反应物中的化学键吸收的能量越多,反应越难进行,根据图示,第Ⅰ步反应断开反应物中的化学键吸收的能量最多,第Ⅰ步反应最难进行,则总反应的反应速率取决于第Ⅰ步;③一定条件下,将$0.6\ \mathrm{mol}\ \mathrm{NO}$和$0.8\ \mathrm{mol}\ \mathrm{H_{2}}$充入$10\ \mathrm{L}$恒容密闭容器中发生反应:$2\mathrm{NO(g)} + 2\mathrm{H_{2}(g)}\rightleftharpoons\mathrm{N_{2}(g)} + 2\mathrm{H_{2}O(g)}$,恒温恒容时,物质的量之比等于其压强之比,则根据图示,$10\ \mathrm{min}$时,容器内气体总物质的量为$(0.6 + 0.8)\ \mathrm{mol}×\frac{1.6}{2.0}=1.12\ \mathrm{mol}$,即$0\sim10\ \mathrm{min}$内,容器内气体减少$(1.4 - 1.2)\ \mathrm{mol}=0.28\ \mathrm{mol}$,由反应式可知,每生成$1\ \mathrm{mol}\ \mathrm{N_{2}}$,混合气体减少$1\ \mathrm{mol}$,此时混合气体减少$0.28\ \mathrm{mol}$,则$0\sim10\ \mathrm{min}$内生成$0.28\ \mathrm{mol}\ \mathrm{N_{2}}$,所以$0\sim10\ \mathrm{min}$内,$v(\mathrm{N_{2}})=\frac{0.28\ \mathrm{mol}}{10\ \mathrm{L}×10\ \mathrm{min}}=2.8×10^{-3}\ \mathrm{mol/(L· min)}$。该反应为可逆反应,反应物的转化率不可能达$100\%$,无论反应多长时间,$n(\mathrm{NO})$不可能变为$0$;④由反应式可得:$v(\mathrm{NO}) = 2v(\mathrm{N_{2}})$,但并未体现同一组正、逆反应速率相等,不能说明反应达到平衡状态,A不符合题意;B.混合气体中$\mathrm{NO}$的物质的量分数不再改变,即$\mathrm{NO}$的浓度不再改变,能说明反应达到平衡状态,B符合题意;C.混合气体质量不变,容器体积不变,混合气体密度始终不变,不能说明反应达到平衡状态,C不符合题意;D.该反应是气体分子数减小的反应,在恒温恒容密闭容器中,混合气体的压强在改变,则当混合气体的压强不再改变时,能说明反应达到平衡状态,D符合题意。]
查看更多完整答案,请扫码查看


