2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
6.【题型二、三】(2025·湖南长沙雅礼中学期中)微型实验药品用量少,绿色环保。如图所示为探究$\mathrm{SO_2}$性质的微型实验,滤纸①~④分别浸泡了相关试剂,实验时向试管中滴入几滴浓硫酸。下列说法正确的是 (

A.滤纸①、②褪色均证明$\mathrm{SO_2}$具有漂白性
B.滤纸③先变红后褪色,体现了$\mathrm{SO_2}$具有酸性氧化物的性质和漂白性
C.滤纸④上有浅黄色固体生成,证明$\mathrm{SO_2}$具有氧化性
D.在制取$\mathrm{SO_2}$的过程中浓硫酸体现了强氧化性
C
)
A.滤纸①、②褪色均证明$\mathrm{SO_2}$具有漂白性
B.滤纸③先变红后褪色,体现了$\mathrm{SO_2}$具有酸性氧化物的性质和漂白性
C.滤纸④上有浅黄色固体生成,证明$\mathrm{SO_2}$具有氧化性
D.在制取$\mathrm{SO_2}$的过程中浓硫酸体现了强氧化性
答案:
6.C[提示:A.碘水褪色证明$\mathrm{SO}_{2}$具有还原性,品红溶液褪色证明$\mathrm{SO}_{2}$具有漂白性,故A错误。B.浓硫酸和亚硫酸钠反应放出二氧化硫气体,体现了浓硫酸的酸性,故D错误。]
7.【题型二、三】(2025·浙江四校联考)实验室进行二氧化硫制备与性质实验的组合装置如图所示(部分固定装置未画出)。

(1)为检验$\mathrm{SO_2}$与$\mathrm{Na_2O_2}$的反应是否有氧气生成,装置B中盛放的试剂X应为 。
(2)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明Ⅰ⁻还原性弱于$\mathrm{SO_2}$的现象为 ,发生反应的离子方程式是 。
(3)为了验证E中$\mathrm{SO_2}$与$\mathrm{FeCl_3}$发生了氧化还原反应,设计了如下实验:取E中的溶液,向溶液中加入用稀硝酸酸化的$\mathrm{BaCl_2}$溶液,产生白色沉淀,说明$\mathrm{SO_2}$与$\mathrm{FeCl_3}$发生了氧化还原反应。上述方案是否合理? (填“合理”或“不合理”),原因是 。
(4)实验过程中G中含酚酞的$\mathrm{NaOH}$溶液逐渐褪色,欲证明褪色的原因是$\mathrm{SO_2}$具有漂白性还是$\mathrm{SO_2}$溶于水显酸性。请设计实验验证:
。

(1)为检验$\mathrm{SO_2}$与$\mathrm{Na_2O_2}$的反应是否有氧气生成,装置B中盛放的试剂X应为 。
浓H2SO4
(2)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明Ⅰ⁻还原性弱于$\mathrm{SO_2}$的现象为 ,发生反应的离子方程式是 。
F中溶液蓝色褪去$ SO2+I2+2H2O=SO4^{2-}+2I^-+4H^+$
(3)为了验证E中$\mathrm{SO_2}$与$\mathrm{FeCl_3}$发生了氧化还原反应,设计了如下实验:取E中的溶液,向溶液中加入用稀硝酸酸化的$\mathrm{BaCl_2}$溶液,产生白色沉淀,说明$\mathrm{SO_2}$与$\mathrm{FeCl_3}$发生了氧化还原反应。上述方案是否合理? (填“合理”或“不合理”),原因是 。
不合理 E中溶解的SO2与稀硝酸反应也能生成$SO4^{2-}$
(4)实验过程中G中含酚酞的$\mathrm{NaOH}$溶液逐渐褪色,欲证明褪色的原因是$\mathrm{SO_2}$具有漂白性还是$\mathrm{SO_2}$溶于水显酸性。请设计实验验证:
取褪色后的溶液,加热,若未变红,则证明褪色原因是SO2溶于水显酸性(或取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色原因是SO2溶于水显酸性)
。
答案:
7.
(1)浓H2SO4
(2)F中溶液蓝色褪去$ SO2+I2+2H2O=SO4^{2-}+2I^-+4H^+ (3)$不合理 E中溶解的SO2与稀硝酸反应也能生成$SO4^{2-} (4)$取褪色后的溶液,加热,若未变红,则证明褪色原因是SO2溶于水显酸性(或取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色原因是SO2溶于水显酸性)[提示:A中反应制备SO2,B中应干燥生成的气体,二氧化硫是酸性气体,应用浓硫酸干燥;D中的氢氧化钠溶液用于吸收多余的SO2,E、F中二氧化硫可表现出还原性,G中二氧化硫被吸收,出现褪色现象,可进一步实验探究酚酞褪色的原理。
(1)Na2O2能与水蒸气反应产生氧气,因此证明SO2与Na2O2反应时要先除去水蒸气,则为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为浓H2SO4。
(2)若SO2的还原性强于I-,按还原剂的还原性大于还原产物,则I2与SO2的水溶液能反应生成硫酸和氢碘酸,故能说明I-还原性弱于SO2的现象为:F中溶液蓝色褪去,发生反应的离子方程式是:$SO2+I2+2H2O=SO4^{2-}+2I^-+4H^+。$
(3)SO2与FeCl3,若发生了氧化还原反应,所得产物有亚铁离子和硫酸根离子,可通过检验硫酸根离子的产生验证E中SO2与FeCl3发生了氧化还原反应,但要防止从其他途径产生的硫酸根离子的干扰,设计了如下实验:取E中的溶液,向溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应,上述方案不合理,原因是:E中溶解的SO2与稀硝酸反应也可生成$SO4^{2-}。$
(4)若褪色的原因是SO2具有漂白性,则褪色后的溶液中酚酞不存在,若褪色的原因是SO2溶于水显酸性,则褪色后的溶液中酚酞存在、氢氧化钠不存在,故可反滴氢氧化钠溶液观察是否变红来判断,也可利用二氧化硫漂白性是“可逆”的,即褪色后的溶液经加热又会变红。则设计的实验方案为:取褪色后的溶液,加热,若未变红,则证明褪色原因是SO2溶于水显酸性(或取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色原因是SO2溶于水显酸性)。]
(1)浓H2SO4
(2)F中溶液蓝色褪去$ SO2+I2+2H2O=SO4^{2-}+2I^-+4H^+ (3)$不合理 E中溶解的SO2与稀硝酸反应也能生成$SO4^{2-} (4)$取褪色后的溶液,加热,若未变红,则证明褪色原因是SO2溶于水显酸性(或取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色原因是SO2溶于水显酸性)[提示:A中反应制备SO2,B中应干燥生成的气体,二氧化硫是酸性气体,应用浓硫酸干燥;D中的氢氧化钠溶液用于吸收多余的SO2,E、F中二氧化硫可表现出还原性,G中二氧化硫被吸收,出现褪色现象,可进一步实验探究酚酞褪色的原理。
(1)Na2O2能与水蒸气反应产生氧气,因此证明SO2与Na2O2反应时要先除去水蒸气,则为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为浓H2SO4。
(2)若SO2的还原性强于I-,按还原剂的还原性大于还原产物,则I2与SO2的水溶液能反应生成硫酸和氢碘酸,故能说明I-还原性弱于SO2的现象为:F中溶液蓝色褪去,发生反应的离子方程式是:$SO2+I2+2H2O=SO4^{2-}+2I^-+4H^+。$
(3)SO2与FeCl3,若发生了氧化还原反应,所得产物有亚铁离子和硫酸根离子,可通过检验硫酸根离子的产生验证E中SO2与FeCl3发生了氧化还原反应,但要防止从其他途径产生的硫酸根离子的干扰,设计了如下实验:取E中的溶液,向溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应,上述方案不合理,原因是:E中溶解的SO2与稀硝酸反应也可生成$SO4^{2-}。$
(4)若褪色的原因是SO2具有漂白性,则褪色后的溶液中酚酞不存在,若褪色的原因是SO2溶于水显酸性,则褪色后的溶液中酚酞存在、氢氧化钠不存在,故可反滴氢氧化钠溶液观察是否变红来判断,也可利用二氧化硫漂白性是“可逆”的,即褪色后的溶液经加热又会变红。则设计的实验方案为:取褪色后的溶液,加热,若未变红,则证明褪色原因是SO2溶于水显酸性(或取褪色后的溶液,滴加较浓的NaOH溶液,若变红,则证明褪色原因是SO2溶于水显酸性)。]
8.【题型二、三】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用煅烧黄铁矿($\mathrm{FeS_2}$,其中硫元素为-1价)的方法制备$\mathrm{SO_2}$:$4\mathrm{FeS_2 +11O_2\xlongequal{高温}8SO_2 +2Fe_2O_3}$,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定$\mathrm{SO_2}$被催化氧化为$\mathrm{SO_3}$的转化率。(已知$\mathrm{SO_3}$的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中$\mathrm{CO_2}$的影响)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:
。
②当停止通入$\mathrm{SO_2}$,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
。
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图所示装置验证二氧化硫的化学性质。
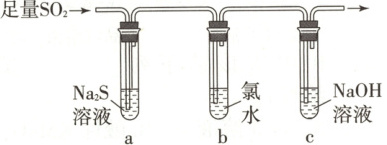
①能说明二氧化硫具有氧化性的实验现象为
。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入$\mathrm{AgNO_3}$溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入$\mathrm{BaCl_2}$溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为
。
(1)工业上用煅烧黄铁矿($\mathrm{FeS_2}$,其中硫元素为-1价)的方法制备$\mathrm{SO_2}$:$4\mathrm{FeS_2 +11O_2\xlongequal{高温}8SO_2 +2Fe_2O_3}$,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
Fe、S 11.2
(2)实验室中用下列装置测定$\mathrm{SO_2}$被催化氧化为$\mathrm{SO_3}$的转化率。(已知$\mathrm{SO_3}$的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中$\mathrm{CO_2}$的影响)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:
打开分液漏斗上口的塞子,旋开分液漏斗的旋塞,缓慢滴加
。
②当停止通入$\mathrm{SO_2}$,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
使残留在装置中的SO2和SO3被充分吸收
。
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
$\frac{m}{80}×\frac{8}{233}×100\%$
(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图所示装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为
试管a中溶液变浑浊(或试管a中有黄色固体生成)
。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入$\mathrm{AgNO_3}$溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入$\mathrm{BaCl_2}$溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为
$SO2+Cl2+2H2O=4H^++SO4^{2-}+2Cl^-$
。
答案:
8.
(1)Fe、S 11.2
(2)①打开分液漏斗上口的塞子,旋开分液漏斗的旋塞,缓慢滴加 ②使残留在装置中的SO2和SO3被充分吸收$ ③\frac{m}{80}×\frac{8}{233}×100\% (3)①$试管a中溶液变浑浊(或试管a中有黄色固体生成$) ②Ⅲ SO2+Cl2+2H2O=4H^++SO4^{2-}+2Cl^-[$提示:
(1)反应中铁元素和硫元素的化合价均升高,两种元素均被氧化,11mol O2参加反应生成8mol SO2时转移电子44mol,故转移2.75mol电子时,生成的SO2在标准状况下的体积为$\frac{2.75}{44}×8×22.4L=11.2L。$
(2)①打开分液漏斗旋塞前,首先要打开分液漏斗上口的塞子,以利于分液漏斗中的液体顺利滴下。②反应停止后还要继续通入一段时间氧气的目的是将产物SO3,以及未反应的SO2全部赶至吸收装置。③装置D中增加的质量为SO3的质量,装置E中沉淀为BaSO4,根据硫元素守恒,被氧化的SO2的物质的量为$\frac{m}{80}mol,$未被氧化的SO2的物质的量为$\frac{n}{233}mol,$故SO2的转化率为$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}×100\%。$
(3)①SO2能将$S^{2-}$氧化,生成硫单质。②方案I中,氯水中的Cl^-也与Ag^+反应,可得到AgCl白色沉淀;方案Ⅱ中品红溶液褪色只能证明b溶液中含有未完全反应的次氯酸或SO2,不能证明有硫酸根离子生成;方案Ⅲ中产生白色沉淀可证明SO2与Cl2发生了氧化还原反应,反应的离子方程式为$SO2+Cl2+2H2O=4H^++SO4^{2-}+2Cl^-。$]
(1)Fe、S 11.2
(2)①打开分液漏斗上口的塞子,旋开分液漏斗的旋塞,缓慢滴加 ②使残留在装置中的SO2和SO3被充分吸收$ ③\frac{m}{80}×\frac{8}{233}×100\% (3)①$试管a中溶液变浑浊(或试管a中有黄色固体生成$) ②Ⅲ SO2+Cl2+2H2O=4H^++SO4^{2-}+2Cl^-[$提示:
(1)反应中铁元素和硫元素的化合价均升高,两种元素均被氧化,11mol O2参加反应生成8mol SO2时转移电子44mol,故转移2.75mol电子时,生成的SO2在标准状况下的体积为$\frac{2.75}{44}×8×22.4L=11.2L。$
(2)①打开分液漏斗旋塞前,首先要打开分液漏斗上口的塞子,以利于分液漏斗中的液体顺利滴下。②反应停止后还要继续通入一段时间氧气的目的是将产物SO3,以及未反应的SO2全部赶至吸收装置。③装置D中增加的质量为SO3的质量,装置E中沉淀为BaSO4,根据硫元素守恒,被氧化的SO2的物质的量为$\frac{m}{80}mol,$未被氧化的SO2的物质的量为$\frac{n}{233}mol,$故SO2的转化率为$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}×100\%。$
(3)①SO2能将$S^{2-}$氧化,生成硫单质。②方案I中,氯水中的Cl^-也与Ag^+反应,可得到AgCl白色沉淀;方案Ⅱ中品红溶液褪色只能证明b溶液中含有未完全反应的次氯酸或SO2,不能证明有硫酸根离子生成;方案Ⅲ中产生白色沉淀可证明SO2与Cl2发生了氧化还原反应,反应的离子方程式为$SO2+Cl2+2H2O=4H^++SO4^{2-}+2Cl^-。$]
查看更多完整答案,请扫码查看


