2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
10.【题型二】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价-物质类别关系如图。
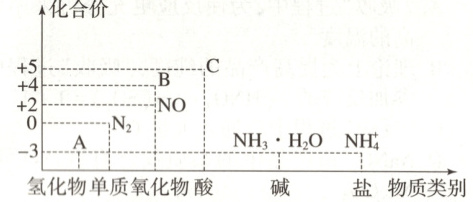
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:
(3)实验室中,检验溶液中含有$NH_4^+$的操作方法是
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:
(5)写出一个人工固氮的化学反应方程式:
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为

回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是
$4NH₃+5O₂\overset{催化剂}{\underset{\triangle}{=\!=\!=}}4NO+6H₂O$
。(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:
C+4HNO₃(浓$)\overset{\triangle}{=\!=\!=}CO₂↑+4NO₂↑+2H₂O$
。(3)实验室中,检验溶液中含有$NH_4^+$的操作方法是
取少量溶液于试管中,加入氢氧化钠溶液,稍微加热,有使湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH₄⁺
。(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:
3NO₂+H₂O═2H⁺+2NO₃⁻+NO
,当反应消耗$3.36\ L$(标准状况)物质B时,转移电子的物质的量为0.1
$mol$。(5)写出一个人工固氮的化学反应方程式:
$N₂+3H₂\overset{催化剂}{\underset{高温、高压}{\rightleftharpoons}}2NH₃($合理即可)
。(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为
3Cu+8H⁺+2NO₃⁻═3Cu²⁺+4H₂O+2NO↑
。
答案:
$10.(1)4NH₃+5O₂\overset{催化剂}{\underset{\triangle}{=\!=\!=}}4NO+6H₂O (2)C+4HNO₃($浓$)\overset{\triangle}{=\!=\!=}CO₂↑+4NO₂↑+2H₂O (3)$取少量溶液于试管中,加入氢氧化钠溶液,稍微加热,有使湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有$NH₄⁺ (4)3NO₂+H₂O═2H⁺+2NO₃⁻+NO 0.1 (5)N₂+3H₂\overset{催化剂}{\underset{高温、高压}{\rightleftharpoons}}2NH₃($合理即可)
(6)3Cu+8H⁺+2NO₃⁻═3Cu²⁺+4H₂O+2NO↑[提示:根据图示信息可知,A为NH₃,B为红棕色气体,则为二氧化氮,C为硝酸。
(1)在催化剂和加热的条件下,物质A生成NO是氨气的催化氧化,生成一氧化氮和水,反应的化学方程式为:$4NH₃+5O₂\overset{催化剂}{\underset{\triangle}{=\!=\!=}}4NO+6H₂O。$
(2)在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO₃(浓$)\overset{\triangle}{=\!=\!=}CO₂↑+4NO₂↑+2H₂O。$
(3)实验室中,检验溶液中含有NH₄⁺的操作方法是:取少量溶液于试管中,加入氢氧化钠溶液,稍微加热,有使湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH₄⁺。
(4)物质B为NO₂,二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:3NO₂+H₂O═2H⁺+2NO₃⁻+NO,反应中氮元素化合价由+4价变为+5价和+2价,3mol二氧化氮反应电子转移总数为2mol,当反应消耗3.36L(标准状况)物质B时,$n(B)=\frac{3.36L}{22.4L·mol⁻¹}=0.15mol,$转移电子的物质的量为$\frac{0.15mol×2}{3}=0.1mol。$
(5)常见的人工固氮是合成氨。
(6)Cu与稀硝酸反应生成的是NO。]
(6)3Cu+8H⁺+2NO₃⁻═3Cu²⁺+4H₂O+2NO↑[提示:根据图示信息可知,A为NH₃,B为红棕色气体,则为二氧化氮,C为硝酸。
(1)在催化剂和加热的条件下,物质A生成NO是氨气的催化氧化,生成一氧化氮和水,反应的化学方程式为:$4NH₃+5O₂\overset{催化剂}{\underset{\triangle}{=\!=\!=}}4NO+6H₂O。$
(2)在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO₃(浓$)\overset{\triangle}{=\!=\!=}CO₂↑+4NO₂↑+2H₂O。$
(3)实验室中,检验溶液中含有NH₄⁺的操作方法是:取少量溶液于试管中,加入氢氧化钠溶液,稍微加热,有使湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有NH₄⁺。
(4)物质B为NO₂,二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:3NO₂+H₂O═2H⁺+2NO₃⁻+NO,反应中氮元素化合价由+4价变为+5价和+2价,3mol二氧化氮反应电子转移总数为2mol,当反应消耗3.36L(标准状况)物质B时,$n(B)=\frac{3.36L}{22.4L·mol⁻¹}=0.15mol,$转移电子的物质的量为$\frac{0.15mol×2}{3}=0.1mol。$
(5)常见的人工固氮是合成氨。
(6)Cu与稀硝酸反应生成的是NO。]
11.【题型一、二】自然界中存在很多物质循环过程。下图是自然界中氮循环示意图,请回答下列问题:
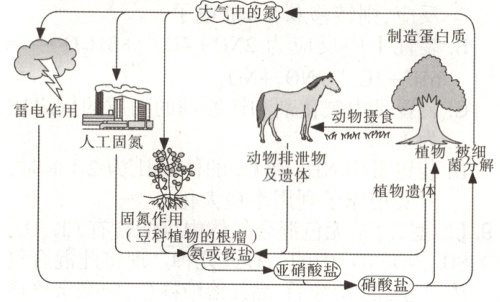
(1)自然界中的固氮和人工固氮的共同点是什么?
(2)硝化细菌可以将氨氧化成亚硝酸,请配平该反应:
(3)根据循环图判断下列说法不正确的是 (
a. 氮元素均被氧化
b. 含氮无机物和含氮有机物可相互转化
c. 工业合成氨属于人工固氮
d. 模拟生物固氮是人工固氮发展的方向

(1)自然界中的固氮和人工固氮的共同点是什么?
(2)硝化细菌可以将氨氧化成亚硝酸,请配平该反应:
2
$NH_3$+3
$O_2 \overset{硝化细菌}{=} $2
$HNO_2$+2
$H_2O$,其中还原产物为HNO₃和H₂O
。(3)根据循环图判断下列说法不正确的是 (
a
)a. 氮元素均被氧化
b. 含氮无机物和含氮有机物可相互转化
c. 工业合成氨属于人工固氮
d. 模拟生物固氮是人工固氮发展的方向
答案:
11.
(1)将游离态的氮转化为化合态的氮。(或将氮气转化为氮的化合物)
(2)2 3 2 2 HNO₃和H₂O
(3)a
(1)将游离态的氮转化为化合态的氮。(或将氮气转化为氮的化合物)
(2)2 3 2 2 HNO₃和H₂O
(3)a
12.【题型二】(2025·湖南长沙雅礼中学月考)
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
$NO_2 + NO + 2NaOH = 2NaNO_2 + H_2O$;
$2NO_2 + 2NaOH = NaNO_2 + NaNO_3 + H_2O$。
①现有$V\ L$某NaOH溶液,能完全吸收$n\ mol\ NO_2$和$m\ mol\ NO$组成的大气污染物。所用烧碱溶液的物质的量浓度至少为
②若所得溶液中$c(NO_3^-) : c(NO_2^-) = 1 : 9$,则原混合气体中$NO_2$和NO的物质的量之比$n : m =$
(2)实验室制取$NO_2$的化学方程式为
将一容积为$40\ mL$的充满NO的试管倒扣于水槽中,然后向试管中通入一定量的$O_2$,试管中恰好充满液体时,通入的$O_2$的体积为
(3)将另一支充满$NO_2$和$O_2$的混合气的试管倒扣于水槽中,若假设生成的溶质不向外扩散,且为标准状况,则所得溶液的物质的量浓度范围约为
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
$NO_2 + NO + 2NaOH = 2NaNO_2 + H_2O$;
$2NO_2 + 2NaOH = NaNO_2 + NaNO_3 + H_2O$。
①现有$V\ L$某NaOH溶液,能完全吸收$n\ mol\ NO_2$和$m\ mol\ NO$组成的大气污染物。所用烧碱溶液的物质的量浓度至少为
$\frac{n+m}{V}$
$mol/L$。②若所得溶液中$c(NO_3^-) : c(NO_2^-) = 1 : 9$,则原混合气体中$NO_2$和NO的物质的量之比$n : m =$
3:2
。(2)实验室制取$NO_2$的化学方程式为
Cu+4HNO₃(浓)═Cu(NO₃)₂+2NO₂↑+2H₂O
。将一容积为$40\ mL$的充满NO的试管倒扣于水槽中,然后向试管中通入一定量的$O_2$,试管中恰好充满液体时,通入的$O_2$的体积为
30
$mL$。(3)将另一支充满$NO_2$和$O_2$的混合气的试管倒扣于水槽中,若假设生成的溶质不向外扩散,且为标准状况,则所得溶液的物质的量浓度范围约为
0.036~0.045
$mol/L$。
答案:
$12.(1)①\frac{n+m}{V} ②3:2 (2)Cu+4HNO₃($浓)═Cu(NO₃)₂+2NO₂↑+2H₂O 30
(3)0.036~0.045[提示:
(1)①NO₂与NaOH发生的反应为:2NO₂+2NaOH═NaNO₃+NaNO₂+H₂O,每2molNO₂消耗2molNaOH,物质的量之比为1:1。NO按物质的量之比1:1混合时,发生的反应为:NO+NO₂+2NaOH═2NaNO₂+H₂O,每1molNO和1molNO₂消耗2molNaOH,即1mol气体消耗1molNaOH。总反应:无论NO和NO₂比例如何,1mol气体都消耗1molNaOH。NO₂和NO的总物质的量为(n+m)mol,故NaOH的物质的量浓度为$\frac{n+m}{V}mol/L。$②依据原混合气体中NO₂与NO的物质的量之比守恒分析:总N原子的物质的量为(n+m)mol,溶液中c(NO₃⁻):c(NO₂⁻)=1:9,则$n(NO₃⁻)=\frac{1}{10}(n+m)mol,$$n(NO₂⁻)=\frac{9}{10}(n+m)mol,$反应拆分:假设xmolNO与xmolNO₂按1:1反应生成NaNO₂,剩余(n-x)molNO₂单独反应:2NO₂+2NaOH═NaNO₃+NaNO₂+H₂O,剩余的NO₂生成$\frac{n-x}{2}molNO₃⁻$和$\frac{n-x}{2}molNO₂⁻,$则有$\frac{9}{10}(n+m)=2x+\frac{n-x}{2},$结合m=x,可得$x=\frac{2n}{3},$可推出n:m=3:2。
(2)实验室制取NO₂是利用铜与浓硝酸反应:Cu+4HNO₃(浓)═Cu(NO₃)₂+2NO₂↑+2H₂O。向充满NO的试管中通入O₂,发生反应:4NO+3O₂+2H₂O═4HNO₃,NO与O₂的体积比为4:3,故O₂体积为:$\frac{3}{4}×40mL=30mL。$
(3)极端情况:①O₂过量,发生反应:4NO₂+O₂+2H₂O═4HNO₃,有:$c_min=\frac{4}{5×22.4}mol/L≈0.036mol/L;$②气体全是NO₂,发生反应:3NO₂+H₂O═2HNO₃+NO,有:$c_max=\frac{1}{22.4}mol/L≈0.045mol/L。$]
(3)0.036~0.045[提示:
(1)①NO₂与NaOH发生的反应为:2NO₂+2NaOH═NaNO₃+NaNO₂+H₂O,每2molNO₂消耗2molNaOH,物质的量之比为1:1。NO按物质的量之比1:1混合时,发生的反应为:NO+NO₂+2NaOH═2NaNO₂+H₂O,每1molNO和1molNO₂消耗2molNaOH,即1mol气体消耗1molNaOH。总反应:无论NO和NO₂比例如何,1mol气体都消耗1molNaOH。NO₂和NO的总物质的量为(n+m)mol,故NaOH的物质的量浓度为$\frac{n+m}{V}mol/L。$②依据原混合气体中NO₂与NO的物质的量之比守恒分析:总N原子的物质的量为(n+m)mol,溶液中c(NO₃⁻):c(NO₂⁻)=1:9,则$n(NO₃⁻)=\frac{1}{10}(n+m)mol,$$n(NO₂⁻)=\frac{9}{10}(n+m)mol,$反应拆分:假设xmolNO与xmolNO₂按1:1反应生成NaNO₂,剩余(n-x)molNO₂单独反应:2NO₂+2NaOH═NaNO₃+NaNO₂+H₂O,剩余的NO₂生成$\frac{n-x}{2}molNO₃⁻$和$\frac{n-x}{2}molNO₂⁻,$则有$\frac{9}{10}(n+m)=2x+\frac{n-x}{2},$结合m=x,可得$x=\frac{2n}{3},$可推出n:m=3:2。
(2)实验室制取NO₂是利用铜与浓硝酸反应:Cu+4HNO₃(浓)═Cu(NO₃)₂+2NO₂↑+2H₂O。向充满NO的试管中通入O₂,发生反应:4NO+3O₂+2H₂O═4HNO₃,NO与O₂的体积比为4:3,故O₂体积为:$\frac{3}{4}×40mL=30mL。$
(3)极端情况:①O₂过量,发生反应:4NO₂+O₂+2H₂O═4HNO₃,有:$c_min=\frac{4}{5×22.4}mol/L≈0.036mol/L;$②气体全是NO₂,发生反应:3NO₂+H₂O═2HNO₃+NO,有:$c_max=\frac{1}{22.4}mol/L≈0.045mol/L。$]
13.【题型一】制备氮化镁的装置示意图如下:
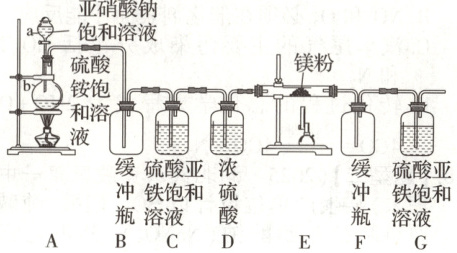
回答下列问题:
(1)检查装置气密性的方法是
(2)写出$NaNO_2$和$(NH_4)_2SO_4$反应制备氮气的化学方程式:
(3)装置C的作用是
(4)写出E中发生反应的化学方程式:

回答下列问题:
(1)检查装置气密性的方法是
微热b,若G中有气泡冒出,停止加热冷却后,G中插在溶液里的导管内形成一段稳定的水柱,则气密性良好
,a的名称是分液漏斗
,b的名称是圆底烧瓶
。(2)写出$NaNO_2$和$(NH_4)_2SO_4$反应制备氮气的化学方程式:
$(NH₄)₂SO₄+2NaNO₂\overset{\triangle}{=\!=\!=}2N₂↑+Na₂SO₄+4H₂O$
。(3)装置C的作用是
除去氧气(及氮氧化物)
,装置D的作用是除去水蒸气
,是否可以把C与D的位置对调并说明理由:不能,对调后无法除去水蒸气
。(4)写出E中发生反应的化学方程式:
$N₂+3Mg\overset{高温}{=\!=\!=}Mg₃N₂$
。
答案:
13.
(1)微热b,若G中有气泡冒出,停止加热冷却后,G中插在溶液里的导管内形成一段稳定的水柱,则气密性良好 分液漏斗 圆底烧瓶$ (2)(NH₄)₂SO₄+2NaNO₂\overset{\triangle}{=\!=\!=}2N₂↑+Na₂SO₄+4H₂O (3)$除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气$ (4)N₂+3Mg\overset{高温}{=\!=\!=}Mg₃N₂$
(1)微热b,若G中有气泡冒出,停止加热冷却后,G中插在溶液里的导管内形成一段稳定的水柱,则气密性良好 分液漏斗 圆底烧瓶$ (2)(NH₄)₂SO₄+2NaNO₂\overset{\triangle}{=\!=\!=}2N₂↑+Na₂SO₄+4H₂O (3)$除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气$ (4)N₂+3Mg\overset{高温}{=\!=\!=}Mg₃N₂$
查看更多完整答案,请扫码查看


